"आवर्त सारणी तत्वों को इस प्रकार प्रदर्शित करने की एक सारणीबद्ध विधि है, जिससे समान गुणों वाले तत्व एक ही ऊर्ध्वाधर स्तंभ या समूह में पाए जाते हैं।"
तत्वों के वर्गीकरण के पहले के प्रयास: डॉबेराइनर ट्रायड्स, न्यूलैंड्स लॉ ऑफ ऑक्टेव्स।
डॉबेराइनर त्रिक: यह वर्गीकरण परमाणु द्रव्यमान पर आधारित है। इसके अनुसार जब तत्वों को बढ़ते हुए परमाणु भार के क्रम में व्यवस्थित किया जाता है तो समान गुणों वाले तीन तत्वों के समूह प्राप्त होते हैं। त्रिक के मध्य तत्व का परमाणु द्रव्यमान अन्य दो तत्वों के परमाणु द्रव्यमान के औसत के लगभग बराबर होता है।
उदाहरण के लिए ली (6.9), ना (23), के (39)।
सीमा: समान गुण होने पर भी यह सभी ज्ञात तत्वों को त्रिक के रूप में व्यवस्थित करने में विफल रहता है।
न्यूलैंड का अष्टक नियम: इसके अनुसार 'जब तत्वों को बढ़ते हुए परमाणु द्रव्यमान के क्रम में रखा जाता है, तो प्रत्येक 8वें तत्व के भौतिक और रासायनिक गुण पहले तत्व के गुणों की पुनरावृत्ति होते हैं।'
न्यूलैंड के सप्तक का रूप निम्न तालिका में दिया गया है: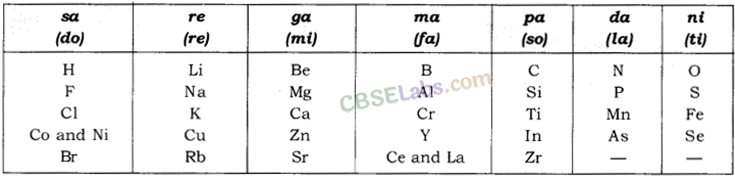
सीमाओं
- अष्टक का नियम केवल कैल्सियम (केवल हल्के तत्वों के लिए) तक ही लागू था।
- न्यूलैंड ने अलग-अलग गुणों वाले दो तत्वों को एक ही स्लॉट (जैसे Co और Ni) में समायोजित किया। उदाहरण के लिए; Co और Ni फ्लोरीन, क्लोरीन, ब्रोमीन और आयोडीन के साथ।
- न्यूलैंड के अनुसार, प्रकृति में केवल 56 तत्व मौजूद थे और भविष्य में और तत्वों की खोज नहीं होगी।
तत्वों के वर्गीकरण के लिए वर्तमान प्रयास: मेंडेलीव की आवर्त सारणी, आधुनिक आवर्त सारणी।
मेंडेलीव की आवर्त सारणी: मेंडेलीव की आवर्त सारणी तत्वों के भौतिक और रासायनिक गुणों और उनके परमाणु द्रव्यमान पर आधारित है।
मेंडेलीव का आवर्त नियम: इसके अनुसार "तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते हैं।"
गुणों की आवर्तता : तत्वों के गुणों की एक निश्चित अंतराल के बाद पुनरावृति गुणों की आवर्तता कहलाती है।
मेंडेलीव की आवर्त सारणी के गुण
- मेंडेलीव ने अपनी तालिका में खाली स्थान छोड़े जो नए तत्वों की खोज के लिए एक विचार प्रदान करता है। उदाहरण: एका-बोरॉन, एका-एल्युमिनियम और एका-सिलिकॉन।
- मेंडेलीव की आवर्त सारणी में कई अनदेखे तत्वों के गुणों की भविष्यवाणी मेंडेलीव की आवर्त सारणी में उनकी स्थिति के आधार पर की गई थी।
- यह कुछ तत्वों के संदिग्ध परमाणु द्रव्यमान को ठीक करने में उपयोगी है।
- नोबल गैसें खोज के बाद आवर्त सारणी को छेड़े बिना मेंडेलीव की आवर्त सारणी में समायोजित हो सकती हैं।
मेंडेलीव की आवर्त सारणी की सीमाएं
(क) हाइड्रोजन के लिए कोई निश्चित स्थिति नहीं: मेंडेलीव की आवर्त सारणी में हाइड्रोजन परमाणु की कोई सही स्थिति नहीं थी।
उदाहरण: क्षार धातुओं और हैलोजन (17वें समूह) के साथ हाइड्रोजन की स्थिति।
(b) समस्थानिकों के लिए कोई स्थान नहीं: समस्थानिकों की स्थिति निश्चित नहीं की गई थी।
उदाहरण: सीएल-35 और सीएल-37।
(सी) परमाणु द्रव्यमान में कोई नियमित प्रवृत्ति नहीं: उच्च परमाणु द्रव्यमान के साथ पहले कम परमाणु द्रव्यमान वाले कुछ तत्वों की स्थिति।
उदाहरण: Co-58.9 से पहले Ni-58.7।
मेंडेलीव की मूल आवर्त सारणी नीचे दी गई तालिका में पुन: प्रस्तुत की गई है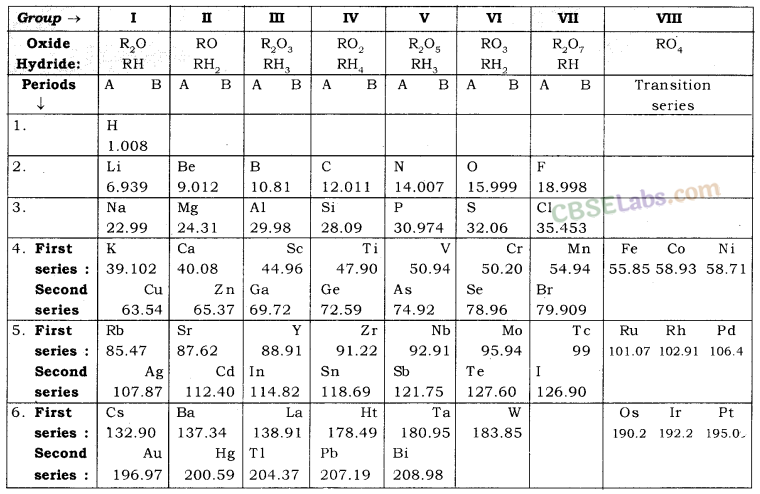
आधुनिक आवर्त सारणी: 1913 में, हेनरी मोस्ले ने दिखाया कि किसी तत्व की परमाणु संख्या उसके परमाणु द्रव्यमान की तुलना में अधिक मौलिक गुण है।
आधुनिक काल नियम: तत्वों के भौतिक और रासायनिक गुण उनके परमाणु क्रमांक के आवर्त फलन होते हैं।
आधुनिक आवर्त सारणी तत्वों की परमाणु संख्या पर आधारित है।
परमाणु क्रमांक (Z) किसी तत्व के परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या के बराबर होता है।
आधुनिक आवर्त सारणी में 18 ऊर्ध्वाधर स्तंभ होते हैं जिन्हें समूह के रूप में जाना जाता है और सात क्षैतिज पंक्तियों को अवधि के रूप में जाना जाता है।
किसी आवर्त में बाएँ से दाएँ जाने पर उपस्थित तत्वों में संयोजकता इलेक्ट्रॉनों की संख्या 1 से बढ़कर 8 हो जाती है।
आवर्त में बाएँ से दाएँ जाने पर कोशों की संख्या समान रहती है।
आवर्त सारणी के एक समूह के सभी तत्वों में वैलेंस इलेक्ट्रॉनों की संख्या समान होती है।
आधुनिक आवर्त सारणी में रुझान: वैलेंसी, परमाणु आकार, धात्विक और अधात्विक लक्षण और इलेक्ट्रोनगेटिविटी।
(i) संयोजकता: किसी तत्व की संयोजकता उसके परमाणु के सबसे बाहरी कोश में उपस्थित संयोजकता इलेक्ट्रॉनों की संख्या से निर्धारित होती है (अर्थात किसी तत्व की संयोजन क्षमता को उसकी संयोजकता के रूप में जाना जाता है)।
आवर्त में: किसी आवर्त में बाएँ से दाएँ जाने पर पहले संयोजकता 1 से 4 तक बढ़ती है और फिर घटकर शून्य (0) हो जाती है।
समूहों में: एक समूह में ऊपर से नीचे जाने पर संयोजकता समान रहती है क्योंकि संयोजकता इलेक्ट्रॉनों की संख्या समान रहती है।
उदाहरण: पहले समूह के तत्वों की संयोजकता = 1 दूसरे समूह के तत्वों की संयोजकता = 2।
(ii) परमाणु आकार: परमाणु आकार परमाणु के त्रिज्या को संदर्भित करता है। यह नाभिक के केंद्र और एक पृथक परमाणु के सबसे बाहरी खोल के बीच की दूरी है।
आवर्त में : किसी आवर्त में बाएँ से दाएँ जाने पर परमाणु आकार घटता है क्योंकि परमाणु आवेश बढ़ता है।
उदाहरण: दूसरी अवधि के तत्वों का आकार: Li> Be> B> C> N> O> F
जानने का बिंदु: इसी अवधि में महान गैसों का परमाणु आकार
पूरी तरह से भरे हुए इलेक्ट्रॉनिक कॉन्फ़िगरेशन (यानी पूर्ण ऑक्टेट) की उपस्थिति के कारण सबसे बड़ा है।
समूह में: परमाणु आकार समूह में नीचे की ओर बढ़ता है क्योंकि
परमाणु आवेश में वृद्धि के बावजूद नए गोले जोड़े जा रहे हैं।
उदाहरण ; पहले समूह के तत्व का परमाणु आकार: Li < Na < K < Rb < Cs < Fr
17वें समूह के तत्वों का परमाणु आकार: F <Cl <Br <I
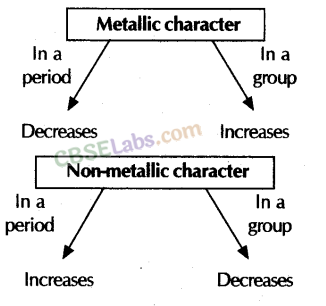
(iii) धात्विक गुण: यह एक परमाणु की इलेक्ट्रॉन खोने की प्रवृत्ति है। आवर्त में: बाएँ से दाएँ आवर्त में धात्विक लक्षण घटते हैं क्योंकि परमाणु आवेश में वृद्धि के कारण इलेक्ट्रॉन खोने की प्रवृत्ति कम हो जाती है। उदाहरण: द्वितीय आवर्त तत्वों का धात्विक गुण: Li > Be > B > C >> N > O > F
समूह में: धात्विक गुण, ऊपर से नीचे जाने पर बढ़ता है क्योंकि परमाणु आकार और इलेक्ट्रॉन खोने की प्रवृत्ति बढ़ जाती है।
उदाहरण: पहला समूह तत्व: ली <ना <के <आरबी <सीएस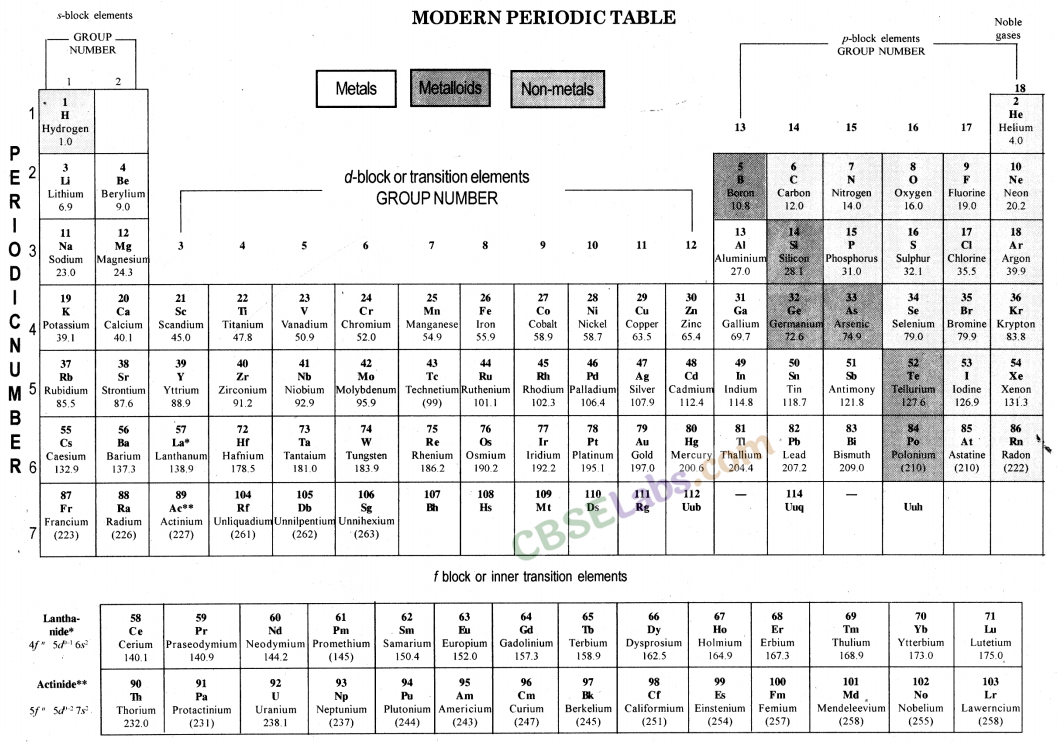
17वें समूह के तत्व: एफ <सीएल <बीआर <आई
(iv) अधात्विक गुण: यह एक परमाणु की इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति है।
आवर्त में: आवर्त में बाएँ से दाएँ जाने पर अधात्विक गुण बढ़ता है क्योंकि नाभिक आवेश में वृद्धि के कारण इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ जाती है। उदाहरण ; दूसरे आवर्त के तत्वों का अधात्विक गुण: Li <Be <B <C <N <O <F समूह में: समूह में ऊपर से नीचे जाने पर अधात्विक गुण कम हो जाता है क्योंकि परमाणु आकार बढ़ जाता है और इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति घट जाती है। . भूतपूर्व। 17वें आवर्त तत्त्व का अधात्विक लक्षण: F > Cl > Br > I
(v)
धातुओं में रासायनिक अभिक्रियाशीलता: धातुओं की रासायनिक अभिक्रियाशीलता समूह में ऊपर से नीचे जाने पर बढ़ जाती है क्योंकि इलेक्ट्रॉन खोने की प्रवृत्ति बढ़ जाती है। उदाहरण ; Li < Na < K < Rb < Cs (प्रथम समूह) अधातुओं में: अधातुओं की रासायनिक अभिक्रियाशीलता समूह में नीचे जाने पर कम हो जाती है क्योंकि इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम हो जाती है। उदाहरण: F > Cl > Br > I (17वां समूह)
(vi) वैद्युतीयऋणात्मकता: यह सहसंयोजी आबंधित अणु में सहसंयोजी आबंधित इलेक्ट्रॉनों के साझा युग्म को अपनी ओर आकर्षित करने की तत्व की प्रवृत्ति है। यह परमाणु आवेश में वृद्धि या परमाणु आकार में कमी के साथ बढ़ता है।
अवधि के साथ वैद्युतीयऋणात्मकता बढ़ जाती है। उदाहरण: ली <बी <बी <सी <एन <ओ <एफ। समूह के नीचे इलेक्ट्रोनगेटिविटी कम हो जाती है। उदाहरण ; ली> ना> के> आरबी> सीएस
एफ> सीएल> ब्र> आई
(vii) ऑक्साइड की प्रकृति धातु ऑक्साइड क्षारीय प्रकृति के होते हैं। भूतपूर्व। Na2O, MgO आदि अधातु
ऑक्साइड अम्लीय प्रकृति के होते हैं। भूतपूर्व। Cl2O7, SO3, P2O5,
धातु प्रतिक्रियाशीलता के मामले में, इलेक्ट्रॉनों को खोने की प्रवृत्ति बढ़ने के कारण यह समूह में बढ़ जाती है।
गैर-धातु प्रतिक्रियाशीलता के मामले में, इलेक्ट्रॉन प्राप्त करने की प्रवृत्ति कम होने के कारण समूह में कमी आती है।
समूह: मेंडेलीव के साथ-साथ आधुनिक आवर्त सारणी में लंबवत स्तंभों को समूह कहा जाता है।
अवधि: आधुनिक आवर्त सारणी और मेंडेलीव की आवर्त सारणी में क्षैतिज पंक्तियों को आवर्त कहा जाता है।
आधुनिक आवर्त सारणी में 18 समूह तथा 7 (सात) आवर्त हैं।
परमाणु आकार: परमाणु आकार को नाभिक के केंद्र और एक पृथक परमाणु के सबसे बाहरी खोल के बीच की दूरी के रूप में देखा जा सकता है।
परमाणु आकार (त्रिज्या) का समूह में नीचे जाने की प्रवृत्ति आवर्त सारणी के समूह में नीचे की ओर जाने पर परमाणु आकार बढ़ता जाता है क्योंकि प्रत्येक चरण पर परमाणुओं में इलेक्ट्रॉनों का एक नया कोश जुड़ता जाता है। परमाणु के सबसे बाहरी कोश के इलेक्ट्रॉनों और नाभिक के बीच की दूरी में वृद्धि होती है।
आवर्त में बाएँ से दाएँ जाने पर परमाणु आकार (त्रिज्या) की प्रवृत्ति आवर्त में बाएँ से दाएँ जाने पर परमाणुओं का आकार घटता है क्योंकि बाएँ से दाएँ जाने पर तत्वों की परमाणु संख्या बढ़ जाती है जिसका अर्थ है कि परमाणुओं में प्रोटॉन और इलेक्ट्रॉनों की संख्या बढ़ जाती है। नाभिक पर अधिक धनात्मक आवेश होने के कारण, इलेक्ट्रॉन नाभिक के अधिक निकट आ जाते हैं और परमाणु का आकार घट जाता है।
JW डॉबेराइनर के त्रिक के लक्षण।
- त्रिक के तत्व समान रासायनिक गुण प्रदर्शित करते हैं।
- त्रिक के ये तत्व अपने भौतिक गुणों में विशिष्ट रुझान दिखाते हैं।
- बीच वाले तत्व का परमाणु द्रव्यमान मोटे तौर पर अन्य दो तत्वों के परमाणु द्रव्यमान का औसत होता है।
उदाहरण: Na का परमाणु द्रव्यमान त्रय Li, Na और K में 23 है। यह परमाणु द्रव्यमान Li और K के परमाणु द्रव्यमान का औसत है, जिनका परमाणु द्रव्यमान क्रमशः 7 और 39 है।
डॉबेराइनर द्वारा गठित त्रिक।
पहला ट्रायड
ली - लिथियम
ना - सोडियम
के - पोटेशियम
दूसरा त्रय
सीए - कैल्शियम
सीनियर - स्ट्रोंटियम
बा - बेरियम
तीसरा ट्रायड
सीएल - क्लोरीन
ब्र - ब्रोमीन
I - आयोडीन
मेंडेलीव का आवर्त नियम: इसमें कहा गया है कि "तत्वों के गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते हैं।" इसका अर्थ है कि तत्वों के गुण उनके परमाणु द्रव्यमान पर निर्भर करते हैं और तत्वों को उनके बढ़ते परमाणु द्रव्यमान के आधार पर आवर्त सारणी में स्थान दिया जाता है।
मेंडेलीव की आवर्त सारणी के गुण
(i) मेंडेलीव ने बाद में खोजे जाने वाले नए तत्वों को समायोजित करने के लिए अपनी तालिका में कई अंतराल छोड़े। इसलिए मेंडेलीव ने साहसपूर्वक कुछ और तत्वों के अस्तित्व की भविष्यवाणी की। उन्होंने इनमें से कुछ तत्वों के गुणों की भी भविष्यवाणी की और उन्हें क्रमशः एका-बोरॉन, एका-एल्युमीनियम और एका-सिलिकॉन नाम दिया। बाद में तत्वों की खोज की गई, उदाहरण के लिए, गैलियम ने एका-एल्युमीनियम का स्थान ले लिया और इसने एल्युमीनियम के समान गुण प्रदर्शित किए।
(ii) उन्होंने तत्वों के मौजूदा क्रम को विचलित किए बिना बाद में खोजी गई महान गैसों को उचित स्थान दिया। उसने उन्हें एक नए समूह में रखा।
मेंडेलीव के वर्गीकरण की सीमाएँ:
- समस्थानिकों की स्थिति की व्याख्या नहीं की जा सकती क्योंकि समस्थानिकों के रासायनिक गुण समान होते हैं लेकिन परमाणु द्रव्यमान भिन्न होते हैं। यदि तत्वों को परमाणु द्रव्यमान के अनुसार व्यवस्थित किया जाता है, तो समस्थानिकों को आवर्त सारणी के विभिन्न समूहों में रखा जाना चाहिए।
- एक तत्व से दूसरे तत्व में जाने पर परमाणु द्रव्यमान नियमित रूप से नहीं बढ़ता है।
- वह अपनी तालिका में हाइड्रोजन को सही स्थान नहीं दे सका क्योंकि हाइड्रोजन में कुछ गुण क्षार धातुओं के समान और कुछ गुण हैलोजन के समान होते हैं।
आधुनिक आवर्त नियम: यह नियम 1913 में एक वैज्ञानिक हेनरी मोस्ले द्वारा प्रस्तावित किया गया था। इस नियम के अनुसार, "तत्वों के गुण उनके परमाणु क्रमांक का आवर्त फलन होते हैं।" इसका अर्थ है कि तत्वों के गुण उनके परमाणु क्रमांक पर निर्भर करते हैं और आवर्त सारणी में तत्वों को उनके बढ़ते परमाणु क्रमांक के आधार पर स्थान दिया जाता है। चूंकि परमाणु संख्या कक्षाओं में इलेक्ट्रॉनों के वितरण को निर्धारित करती है, और सबसे बाहरी कक्षा के इलेक्ट्रॉन तत्व के गुणों को निर्धारित करते हैं।
मॉडम (दीर्घ रूप) आवर्त सारणी में समूह और आवर्त: आधुनिक (या दीर्घ रूप) आवर्त सारणी में 18 समूह (ऊर्ध्वाधर स्तंभ) और 7 आवर्त (क्षैतिज रेखाएँ) हैं। अवधि की संख्या उस अवधि से संबंधित तत्वों के परमाणुओं में कोशों की संख्या के बराबर है।
मेंडेलीव की आवर्त सारणी में रुझान
- तत्वों के गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते हैं।
- इसके 8 समूह हैं।
- किसी तत्व के समस्थानिकों को कोई स्थान नहीं दिया जा सकता।
- मेंडेलीव ने अपनी आवर्त सारणी में तीन अंतराल छोड़े थे।
- इस आवर्त सारणी में हाइड्रोजन को कोई निश्चित स्थान नहीं दिया गया।
- धातुओं और अधातुओं में कोई भेद नहीं किया गया।
- संक्रमण तत्वों को समूह VIII में एक साथ रखा गया है।
- मेंडेलीव के समय अक्रिय गैसों का पता नहीं था।
मॉडेम आवर्त सारणी में रुझान
(i) वैलेंसी: एक ही समूह से संबंधित तत्वों में वैलेंस इलेक्ट्रॉनों की संख्या समान होती है और इस प्रकार समान वैलेंसी होती है। किसी आवर्त विशेष में बाएँ से दाएँ जाने पर संयोजकता पहले धनात्मक संयोजकता के रूप में बढ़ती है और फिर ऋणात्मक संयोजकता के रूप में घटती है।
उदाहरण: दूसरी अवधि के तत्वों में:
Li की 1 + संयोजकता है, फिर Be 2+ , B 3+ , C 4+ सहसंयोजकता, N 3- संयोजकता, फिर O 2- और F (-) संयोजकता।
(ii) परमाणु आकार या परमाणु त्रिज्या बढ़ती है: जैसे- जैसे हम समूह में नीचे की ओर बढ़ते हैं और आवर्त में बाएँ से दाएँ जाने पर यह घटता जाता है। कोशों की संख्या में वृद्धि के कारण एक समूह में नीचे जाने पर परमाणु आकार बढ़ता है। परमाणु आवेश में वृद्धि के कारण परमाणु आकार एक अवधि के साथ घटता जाता है जो इलेक्ट्रॉनों को नाभिक के करीब खींचता है और परमाणु के आकार को कम करता है।
(iii) धात्विक और अधात्विक गुण आधुनिक आवर्त सारणी में धातुएँ बाईं ओर और अधातुएँ दाईं ओर होती हैं। उपधातुओं की टेढ़ी-मेढ़ी रेखा धातुओं को अधातुओं से अलग करती है।
- आवर्त में बाएँ से दाएँ जाने पर धात्विक लक्षण घटते हैं और समूह में नीचे जाने पर बढ़ते हैं।
- किसी आवर्त में विद्युतऋणात्मकता में वृद्धि के कारण अधात्विक गुण आवर्त में बाएँ से दाएँ बढ़ते हैं और समूह में नीचे जाने पर परमाणुओं की विद्युतऋणात्मकता में कमी के कारण समूह में ऊपर से नीचे की ओर जाने पर ये लक्षण घटते हैं।
1. तत्वों के वर्गीकरण की आवश्यकता:
विभिन्न तत्वों की खोज में वृद्धि ने तत्वों के बारे में ज्ञात सभी को व्यवस्थित करना कठिन बना दिया। बड़ी संख्या में तत्वों का आसानी से अध्ययन करने के लिए विभिन्न प्रयास किए गए। इन प्रयासों के परिणामस्वरूप तत्वों का धातु और अधातु में वर्गीकरण किया गया।
2. डॉबेराइनर के त्रिक:
जोहान वोल्फगैंग डोबेराइनर, एक जर्मन रसायनज्ञ, ने ज्ञात तत्वों को उनके गुणों में समानता के आधार पर तीन तत्वों के समूहों में वर्गीकृत किया। इन समूहों को त्रिक कहा जाता था।
(i) त्रिक के लक्षण:
- प्रत्येक त्रय में तत्वों के गुण समान थे।
- बीच वाले तत्व का परमाणु द्रव्यमान मोटे तौर पर अन्य दो तत्वों के परमाणु द्रव्यमान का औसत था।
(ii) त्रिक के उदाहरण:
(iii) सीमाएँ: डॉबेराइनर केवल तीन त्रिक की पहचान कर सका। वह सभी ज्ञात तत्वों के त्रिक तैयार करने में सक्षम नहीं था।
3. न्यूलैंड्स का अष्टक का नियम:
एक अंग्रेज वैज्ञानिक जॉन न्यूलैंड्स ने ज्ञात तत्वों को बढ़ते हुए परमाणु द्रव्यमान के क्रम में व्यवस्थित किया और इसे 'अष्टक का नियम' कहा। इसे 'न्यूलैंड्स' के अष्टक नियम के रूप में जाना जाता है।
(i) न्यूलैंड्स के अष्टक नियम की विशेषताएं:
- इसमें हाइड्रोजन से लेकर थोरियम तक के तत्व शामिल थे।
- प्रत्येक आठवें तत्व के गुण पहले तत्व के समान थे।
(ii) न्यूलैंड्स के ऑक्टेव्स को दर्शाने वाली तालिका:
(iii) न्यूलैंड्स के ऑक्टेव्स के कानून की सीमाएं:
- यह नियम कैल्सियम (Ca) तक के तत्वों पर लागू होता था।
- इसमें केवल 56 तत्व थे।
- तालिका में तत्वों को फिट करने के लिए, न्यूलैंड्स ने कोबाल्ट और निकल जैसे दो तत्वों को एक ही स्लॉट में समायोजित किया और एक ही नोट के तहत कुछ विपरीत तत्वों को भी रखा।
4. मेंडेलीव की आवर्त सारणी: दमित्री इवानोविच - 5' मेंडेलीव, एक रूसी देवता, तत्वों की आवर्त सारणी के शुरुआती विकास में सबसे महत्वपूर्ण योगदानकर्ता थे, जिसमें तत्वों को उनके परमाणु द्रव्यमान और रासायनिक गुणों के आधार पर व्यवस्थित किया गया था।
- मेंडेलीव की आवर्त सारणी के लक्षण:
- मेंडेलीव ने सभी 63 ज्ञात तत्वों को उनके परमाणु भार के बढ़ते क्रम में व्यवस्थित किया।
- तालिका में लंबवत स्तंभ होते हैं जिन्हें 'समूह' कहा जाता है और क्षैतिज पंक्तियां 'अवधि' कहलाती हैं।
- समान भौतिक और रासायनिक गुणों वाले तत्व एक ही समूह के अंतर्गत आते हैं।
- मेंडेलीव का आवर्त नियम: तत्वों के गुण उनके परमाणु द्रव्यमान के आवर्त फलन होते हैं।
- मेंडेलीव की आवर्त सारणी की उपलब्धियां:
- इस तालिका के माध्यम से विभिन्न तत्वों के भौतिक और रासायनिक गुणों का अध्ययन करना बहुत आसान हो गया था।
- मेंडेलीव ने थोड़े अधिक परमाणु द्रव्यमान वाले तत्वों को थोड़े कम परमाणु द्रव्यमान वाले तत्वों से पहले समायोजित किया, ताकि समान गुणों वाले तत्वों को एक साथ रखा जा सके। उदाहरण के लिए, एल्यूमीनियम सिलिकॉन से पहले दिखाई दिया, कोबाल्ट निकल से पहले दिखाई दिया।
- मेंडेलीव ने अपनी आवर्त सारणी में कुछ अंतराल छोड़े।
उन्होंने कुछ ऐसे तत्वों के अस्तित्व की भविष्यवाणी की थी जो उस समय खोजे नहीं गए थे। उनकी भविष्यवाणियां काफी हद तक सच थीं क्योंकि स्कैंडियम, गैलियम और जर्मेनियम जैसे तत्वों की खोज बाद में हुई थी। - हीलियम, नियोन और आर्गन जैसी गैसें, जो बाद में खोजी गईं, उन्हें मौजूदा क्रम को छेड़े बिना एक नए समूह में रखा गया।
- सीमाएं:
- मेंडेलीव की आवर्त सारणी में हाइड्रोजन को कोई निश्चित स्थान नहीं दिया गया था।
- मेंडेलीव की आवर्त सारणी के अनुसार सभी तत्वों के समस्थानिकों की स्थिति निश्चित नहीं थी।
- एक तत्व से दूसरे तत्व में जाने पर परमाणु द्रव्यमान में नियमित रूप से वृद्धि नहीं हुई।
5. आधुनिक आवर्त सारणी : हेनरी मोसले ने एक नया ! तत्वों की संपत्ति, 'परमाणु संख्या' और इसे आधुनिक आवर्त सारणी के आधार के रूप में अपनाया गया था।
(i) आधुनिक आवर्त नियमः तत्वों के गुण उनके परमाणु क्रमांक का आवर्ती फलन होते हैं।
(ii) आधुनिक आवर्त सारणी में तत्वों की स्थिति:
- आधुनिक आवर्त सारणी में 18 समूह और 7 आवर्त हैं।
- किसी एक समूह में मौजूद तत्वों में वैलेंस इलेक्ट्रॉनों की संख्या समान होती है। साथ ही, जैसे-जैसे हम समूह में नीचे जाते हैं, कोशों की संख्या बढ़ती जाती है।
- किसी एक आवर्त में उपस्थित तत्वों में कोशों की संख्या समान होती है। साथ ही, बाएँ से दाएँ जाने पर परमाणु संख्या में एक इकाई की वृद्धि के साथ, संयोजी कोश इलेक्ट्रॉनों में एक इकाई की वृद्धि होती है।
- प्रत्येक अवधि में एक नया इलेक्ट्रॉनिक खोल भर जाता है।
(iii) पहले 20 तत्वों के इलेक्ट्रॉनिक विन्यास को दर्शाने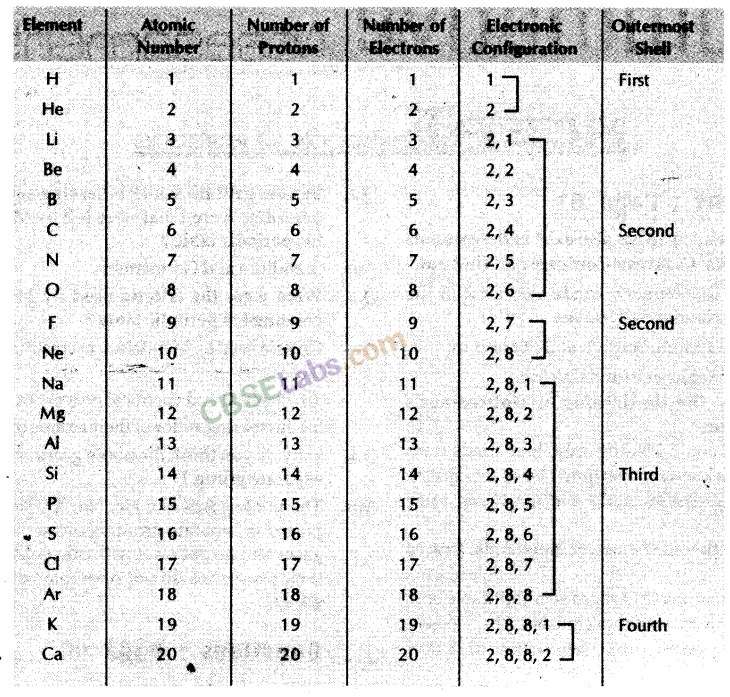
वाली तालिका: आधुनिक आवर्त सारणी में रुझान:
- वैलेंसी: किसी तत्व की वैलेंस उसके परमाणु के सबसे बाहरी शेल में मौजूद वैलेंस इलेक्ट्रॉनों की संख्या से निर्धारित होती है।
- किसी विशेष समूह में तत्वों की संयोजकता समान होती है।
- किसी आवर्त में तत्वों की संयोजकता पहले एक से बढ़कर चार हो जाती है और फिर घटकर शून्य हो जाती है।
- परमाणु आकार: परमाणु आकार एक परमाणु की त्रिज्या को संदर्भित करता है।
- आवर्त में बाएँ से दाएँ जाने पर परमाणु आकार और त्रिज्याएँ घटती जाती हैं।
- एक समूह में ऊपर से नीचे जाने पर परमाणु आकार और त्रिज्याएँ बढ़ती हैं।
धात्विक और अधात्विक गुण:
- किसी परमाणु के बाह्यतम कोश से इलेक्ट्रॉन त्यागने की प्रवृत्ति को तत्व का धात्विक गुण कहते हैं।
- परमाणु के बाह्यतम कोश से इलेक्ट्रॉन प्राप्त करने की प्रवृत्ति को तत्व का अधात्विक गुण कहते हैं।





0 Comments