कार्बन में बंधन: सहसंयोजक बंधन, इलेक्ट्रॉन बिंदु संरचना, कार्बनिक यौगिकों के भौतिक गुण, कार्बन के आवंटन।
सहसंयोजक बंधन: कार्बन की परमाणु संख्या 6 है। इसका इलेक्ट्रॉनिक कॉन्फ़िगरेशन 2, 4 है। इसे निष्क्रिय गैस इलेक्ट्रॉनिक कॉन्फ़िगरेशन प्राप्त करने के लिए 4 इलेक्ट्रॉनों की आवश्यकता होती है। लेकिन कार्बन आयनिक बंधन नहीं बना सकता
यह C4- धनायन बनाने वाले चार इलेक्ट्रॉन प्राप्त कर सकता है । लेकिन छह प्रोटॉन वाले नाभिक के लिए दस इलेक्ट्रॉनों को पकड़ना मुश्किल होगा।
यह C4 + धनायन बनाने वाले चार इलेक्ट्रॉनों को खो सकता है। लेकिन चार इलेक्ट्रॉनों को निकालने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता होती है।
इस प्रकार, कार्बन अपने वैलेंस इलेक्ट्रॉनों को अन्य कार्बन परमाणुओं या अन्य तत्वों के परमाणुओं के साथ साझा करके इस समस्या पर काबू पाता है।
एक अणु में दो परमाणुओं के बीच इलेक्ट्रॉन युग्मों के आपसी बंटवारे से बनने वाले बंधन को सहसंयोजक बंधन के रूप में जाना जाता है।
सहसंयोजक बंधन के प्रकार:
- एकल सहसंयोजक बंधन: जब एक अणु में दो परमाणुओं के बीच इलेक्ट्रॉनों की एक जोड़ी साझा की जाती है। उदाहरण के लिए; एफ 2 , सीएल 2 , एच 2 आदि।
- दोहरा सहसंयोजक बंधन: जब एक अणु में दो परमाणुओं के बीच इलेक्ट्रॉनों के दो जोड़े साझा किए जाते हैं। उदाहरण के लिए; ओ 2 , सीओ 2 आदि।
- ट्रिपल सहसंयोजक बंधन: जब एक अणु में दो परमाणुओं के बीच इलेक्ट्रॉनों के तीन जोड़े साझा किए जाते हैं। उदाहरण के लिए; एन 2 आदि।
इलेक्ट्रॉन डॉट संरचना: इलेक्ट्रॉन डॉट संरचना इलेक्ट्रॉनों और ऑक्टेट नियम के साझा जोड़े के संदर्भ में अणुओं में बंधन की एक तस्वीर प्रदान करती है।
हाइड्रोजन अणु का निर्माण हाइड्रोजन की
परमाणु संख्या = 1
वैलेंस इलेक्ट्रॉनों की संख्या = 1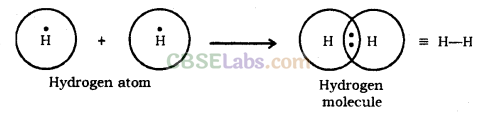
सीएच 4
का निर्माण कार्बन की परमाणु संख्या = 6 [2, 4] वैलेंस
इलेक्ट्रॉनों की संख्या = 4
हाइड्रोजन की परमाणु संख्या = 1
वैलेंस इलेक्ट्रॉनों की संख्या = 1
CO2 का निर्माण अणु
कार्बन की परमाणु संख्या = 6 [2, 4] वैलेंस
इलेक्ट्रॉनों की संख्या = 4
ऑक्सीजन की परमाणु संख्या = 8 [2, 6]
वैलेंस इलेक्ट्रॉनों की संख्या = 6
H2S अणु का बनना सल्फर की परमाणु संख्या = 16 [ 2
, 8, 6]
संयोजी इलेक्ट्रॉनों की संख्या = 6
कार्बनिक यौगिकों के भौतिक गुण
इन अणुओं के बीच आकर्षण के कमजोर बल (यानी, आकर्षण के अंतर-आणविक बल) के कारण अधिकांश कार्बनिक यौगिकों का क्वथनांक और गलनांक कम होता है।
मुक्त इलेक्ट्रॉनों और मुक्त आयनों की अनुपस्थिति के कारण अधिकांश कार्बन यौगिक विद्युत के कुचालक होते हैं।
| यौगिकों | एमपी (के) | बीपी (के) |
| एसिटिक अम्ल ( CH3COOH ) | 290 | 391 |
| क्लोरोफॉर्म ( CHCl3 ) | 209 | 334 |
| इथेनॉल (सीएच 3 सीएच 2 ओएच) | 156 | 351 |
| मीथेन (सीएच 4 ) | 90 | 111 |
कार्बन
अपररूप के अपरूप: वह परिघटना जिसमें तत्व दो या दो से अधिक विभिन्न भौतिक अवस्थाओं में समान रासायनिक गुणों के साथ मौजूद होता है, अपररूप कहलाती है।
कार्बन के तीन मुख्य अलॉट्रोप हैं
- हीरा: इसमें कार्बन, एक परमाणु कार्बन के चार अन्य परमाणुओं से बंध कर त्रि-आयामी संरचना बनाता है। यह सबसे कठोर पदार्थ और कुचालक है। इसका उपयोग ड्रिलिंग चट्टानों और काटने के लिए किया जाता है। इसका उपयोग आभूषण बनाने में भी किया जाता है।
- ग्रेफाइट: इसमें प्रत्येक कार्बन परमाणु तीन अन्य कार्बन परमाणुओं से जुड़ा होता है। यह बिजली का अच्छा संवाहक है और स्नेहक के रूप में उपयोग किया जाता है।
- बकमिंस्टर फुलरीन: यह 60 कार्बन परमाणुओं के कार्बन युक्त क्लस्टर का एक आवंटन है जो गोलाकार अणुओं को बनाने के लिए एक साथ जुड़ जाता है। यह कमरे के तापमान पर गहरा ठोस होता है।
कार्बन की बहुमुखी प्रकृति, हाइड्रोकार्बन, समावयवता, सजातीय श्रृंखला, कार्यात्मक समूह, कार्यात्मक समूहों का नामकरण।
कार्बन की बहुमुखी प्रकृति: इतनी बड़ी संख्या में कार्बनिक यौगिकों का अस्तित्व कार्बन की निम्न प्रकृति के कारण है,
- श्रृंखलन
- टेट्रावैलेंट प्रकृति।
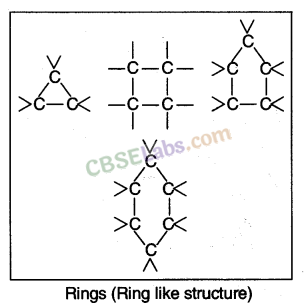
(i) श्रृंखलन: किसी तत्व का मुख्य रूप से कार्बन परमाणु सहसंयोजक बंधों के माध्यम से लंबे सीधे, शाखित और विभिन्न आकारों के वलय बनाने के लिए स्व-संयोजी गुण को श्रृंखलन कहा जाता है।
यह संपत्ति के कारण है
- कार्बन परमाणु का छोटा आकार।
- कार्बन-कार्बन बंधन की महान शक्ति।
कार्बन स्वयं के साथ और अन्य तत्वों के परमाणुओं के साथ स्थिर बहुबंध (डबल या ट्रिपल) भी बना सकता है।
स्ट्रेट चेन
ब्रांच्ड चेन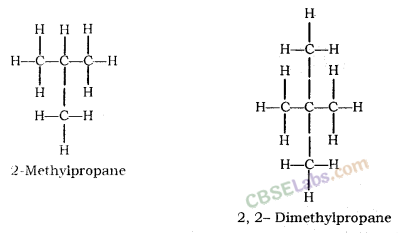
रिंग्स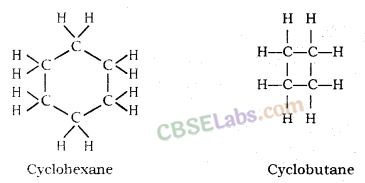
(ii) चतुसंयोजी प्रकृति कार्बन की संयोजकता चार होती है। यह कार्बन के चार अन्य परमाणुओं या एकल सहसंयोजक बंधन के साथ-साथ दोहरे या तिहरे बंधन वाले कुछ अन्य विषम परमाणुओं के साथ संबंध बनाने में सक्षम है।
हाइड्रोकार्बन: कार्बन और हाइड्रोजन के यौगिकों को हाइड्रोकार्बन के रूप में जाना जाता है।
उदाहरण के लिए; मीथेन (CH4 ) , एथेन (C2H6 ) , एथीन ( C2H4 ) , एथाइन ( C2H2 ) आदि ।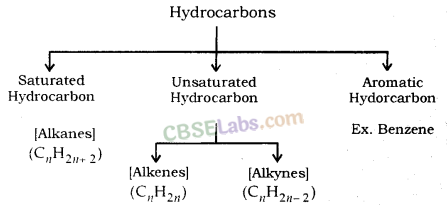
संतृप्त हाइड्रोकार्बन (Alkanes): सामान्य सूत्र C n H 2n+2 है।
n = कार्बन परमाणुओं की संख्या।
इसमें कार्बन परमाणु केवल एक बंधन द्वारा जुड़े होते हैं।
उदाहरण के लिए; मीथेन (CH4 ) , एथेन (C2H6 ) आदि ।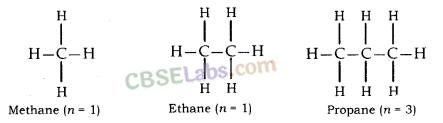
असंतृप्त हाइड्रोकार्बन
ऐल्कीन: सामान्य सूत्र C n H 2n है , जहाँ n = कार्बन परमाणुओं की संख्या।
इसमें कार्बन के दो परमाणु द्विबंध द्वारा जुड़े होते हैं।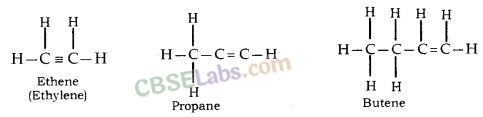
Alkynes: सामान्य सूत्र C n H 2n-2 है , जहाँ n = कार्बन परमाणुओं की संख्या। इसमें दो कार्बन परमाणु त्रिबंध द्वारा जुड़े होते हैं।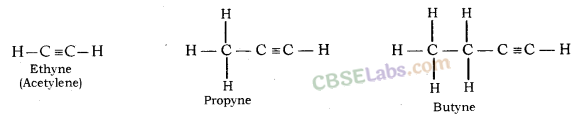
हाइड्रोकार्बन की इलेक्ट्रॉन डॉट संरचना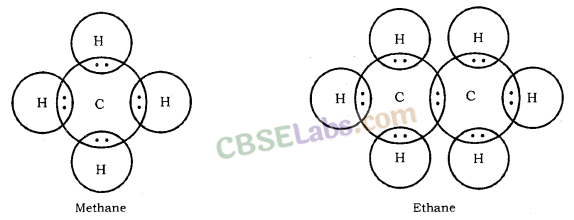
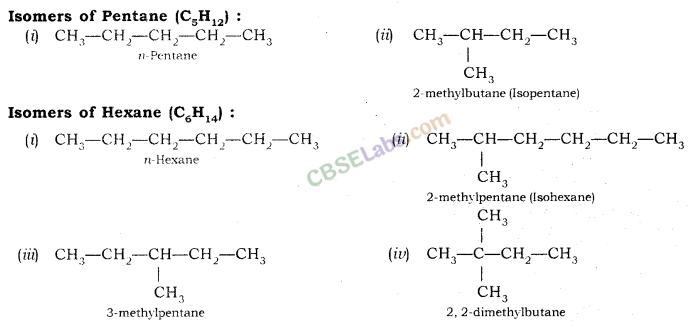
समावयवता (Isomerism): जिन यौगिकों का अणुसूत्र समान होता है लेकिन संरचनात्मक सूत्र और गुण भिन्न होते हैं उन्हें समावयवी कहते हैं और इस घटना को समावयवता कहते हैं।
संरचनात्मक समावयवता (Structural Isomerism)-ऐसे यौगिक जिनका अणुसूत्र समान हो परन्तु संरचना भिन्न हो, संरचनात्मक समावयवी कहलाते हैं। उदाहरण : ब्यूटेन के समावयव ( C4H10 )
सजातीय श्रेणी: समान कार्यात्मक समूह और रासायनिक गुणों वाले कार्बनिक यौगिकों की श्रृंखला और क्रमिक सदस्य CH 2 इकाई या 14 द्रव्यमान इकाइयों से भिन्न होते हैं जिन्हें समजातीय श्रृंखला के रूप में जाना जाता है।
अल्केन्स, अल्केन्स और अल्काइन्स की सजातीय श्रृंखला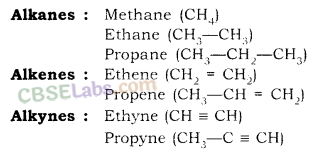
सजातीय श्रृंखला की विशेषता
- सजातीय श्रृंखला में क्रमिक सदस्य CH 2 इकाई या 14 द्रव्यमान इकाई से भिन्न होते हैं।
- दी गई सजातीय श्रेणी के सदस्यों का एक ही प्रकार्यात्मक समूह होता है।
- सजातीय श्रेणी के सभी सदस्य समान रासायनिक गुण प्रदर्शित करते हैं।
प्रकार्यात्मक समूह (Functional Group)- किसी अणु में उपस्थित परमाणु या परमाणुओं का समूह जो मुख्य रूप से इसके रासायनिक गुणों को निर्धारित करता है, क्रियात्मक समूह कहलाता है।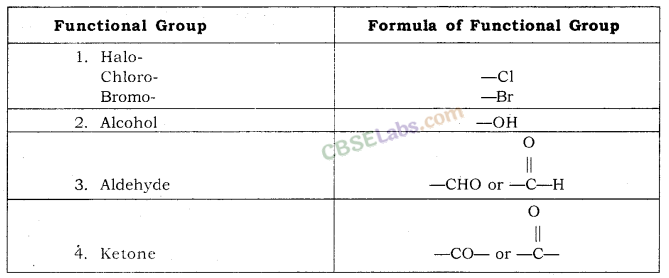
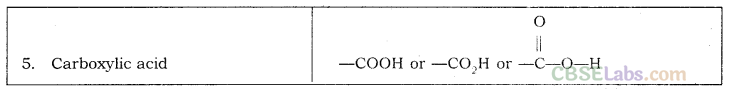
कार्बनिक यौगिकों का नामकरण: लाखों यौगिकों को उनके व्यक्तिगत सामान्य नाम से याद रखना मुश्किल है। इस प्रकार, कार्बनिक यौगिकों के नामकरण को व्यवस्थित करने के लिए IUPAC (इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री) ने कुछ नियम दिए हैं जो इस प्रकार हैं:
1. यौगिक में कार्बन परमाणुओं की संख्या की पहचान करें
| क्र.सं | कार्बन परमाणुओं की संख्या | शब्द जड़ (-) (प्रत्यय) | एकल बंधन |
| 1. | एक कार्बन परमाणु (1-सी) | meth | + अनी |
| 2. | दो कार्बन परमाणु (2-सी) | एथ | + अनी |
| 3. | तीन कार्बन परमाणु (3-सी) | प्रोप | + अनी |
| 4. | चार कार्बन परमाणु (4-सी) | परंतु | + अनी |
| 5. | पांच कार्बन परमाणु (5-सी) | बंद किया हुआ | + अनी |
| 6. | छह कार्बन परमाणु (6-सी) | हेक्स | + अनी |
2. कार्यात्मक समूह की पहचान करें
| क्र.सं. | कार्यात्मक समूह | उपसर्ग | प्रत्यय |
| 1. | दोहरा बंधन (=) | — | एनी |
| 2. | ट्रिपल बॉन्ड (≡) | — | हमारी |
| 3. | क्लोरीन (—Cl) | क्लोरो | — |
| 4. | ब्रोमीन (—Br) | ब्रोमो | — |
| 5. | अल्कोहल (-ओएच) | — | राजभाषा |
| 6. | एल्डिहाइड (-CHO) | — | अल |
| 7. | कीटोन (-CO-) | — | एक |
| 8. | कार्बोक्जिलिक एसिड (-COOH) | — | ओइक एसिड |
3. उपसर्ग + मूल + प्रत्यय क्रम के अनुसार यौगिकों के नाम लिखिए

कार्बन यौगिकों के रासायनिक गुण: महत्वपूर्ण रासायनिक गुण इस प्रकार हैं:
1. दहन: हवा में कार्बन यौगिकों के पूर्ण दहन से कार्बन डाइऑक्साइड पानी, गर्मी और प्रकाश मिलता है।
सीएच 3 सीएच 2 ओएच (एल) + ओ 2 (जी) → सीओ 2 (जी) + एच 2 ओ (एल) + गर्मी और प्रकाश
कार्बन हवा या ऑक्सीजन में जलकर कार्बन डाइऑक्साइड और गर्मी और प्रकाश देता है।
C(s) + O2 ( g) → CO2 ( g) + ऊष्मा और प्रकाश
हवा या ऑक्सीजन की पर्याप्त आपूर्ति की उपस्थिति में संतृप्त हाइड्रोकार्बन नीली लौ के साथ जलते हैं।
सीएच 4 (जी) + 2ओ 2 (जी) → सीओ 2 (जी) + 2 एच 2 ओ (एल) + गर्मी और प्रकाश
हवा की सीमित आपूर्ति की उपस्थिति में, संतृप्त हाइड्रोकार्बन एक कालिखदार ज्वाला बनाता है।
असंतृप्त हाइड्रोकार्बन एक पीली धुएँ वाली लौ के साथ जलते हैं।
घर में इस्तेमाल होने वाले गैस और मिट्टी के तेल के चूल्हे में हवा के लिए इनलेट होता है, जिससे जलकर स्वच्छ नीली लौ मिलती है।
नाइट्रोजन और सल्फर की थोड़ी मात्रा की उपस्थिति के कारण, कोयला और पेट्रोलियम नाइट्रोजन और सल्फर के ऑक्साइड के साथ कार्बन डाइऑक्साइड पैदा करते हैं जो प्रमुख प्रदूषक हैं।
2. ऑक्सीकरण: ऑक्सीकरण एजेंटों की उपस्थिति में इथेनॉल के ऑक्सीकरण से एथेनोइक एसिड बनता है।
ऑक्सीकारक एजेंट: कुछ पदार्थ दूसरों को ऑक्सीजन जोड़ने में सक्षम होते हैं, उन्हें ऑक्सीकारक के रूप में जाना जाता है।
उदाहरण: क्षारीय KMnO 4 (या KMnO 4 —KOH)
अम्लीय K 2 Cr 2 O 7 (या K 2 Cr 2 O 7 —H 2 SO 4 )
KMnO 4 - पोटेशियम परमैंगनेट
K 2 Cr 2 O 7 - पोटेशियम डाइक्रोमेट
3. योगज अभिक्रिया (Addition Reaction) : निकल या प्लेटिनम या पैलेडियम जैसे उत्प्रेरकों की उपस्थिति में असंतृप्त हाइड्रोकार्बन के साथ डाइहाइड्रोजन का योग हाइड्रोजनीकरण (अतिरिक्त) अभिक्रिया कहलाती है।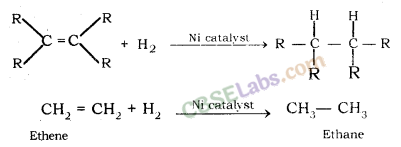
उत्प्रेरक (Catalyst) : वे पदार्थ जो किसी अभिक्रिया को उत्पन्न करते हैं या उसके उपभोग के बिना भिन्न दर पर आगे बढ़ते हैं, उत्प्रेरक कहलाते हैं। उदाहरण के लिए; नी, पं।, पीडी, आदि।
वनस्पति तेल को ठोस वसा (वनस्पति घी) में बदलने की प्रक्रिया को तेल का हाइड्रोजनीकरण कहते हैं।
वनस्पति तेल + एच 2
वनस्पति वसा संतृप्त वसा होते हैं जो स्वास्थ्य के लिए हानिकारक होते हैं।
असंतृप्त वसा अम्ल युक्त वनस्पति तेल स्वास्थ्य के लिए अच्छा होता है।
4. प्रतिस्थापन अभिक्रिया: एक कार्बनिक अणु के एक या अधिक हाइड्रोजन परमाणु का दूसरे परमाणु या परमाणु के समूह द्वारा प्रतिस्थापन को प्रतिस्थापन अभिक्रिया कहते हैं।
कुछ महत्वपूर्ण कार्बन यौगिक: एथेनॉल
( CH3CH2 — OH ): सामान्यतः एथिल अल्कोहल के रूप में जाना जाता है। भौतिक गुण
- यह रंगहीन, ज्वलनशील तरल है।
- यह पानी के साथ सभी अनुपातों में मिश्रणीय है।
- लिटमस पेपर पर इसका कोई प्रभाव नहीं पड़ता है।
रासायनिक गुण
- सोडियम के साथ प्रतिक्रिया

- केंद्रित H2SO4 के साथ प्रतिक्रिया (निर्जलीकरण प्रतिक्रिया)
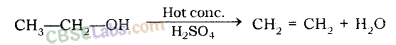
निर्जलीकरण एजेंट: वे पदार्थ जो इथेनॉल (अल्कोहल) से पानी को हटाते हैं, निर्जलीकरण एजेंट के रूप में जाने जाते हैं। उदाहरण के लिए; शंकु। एच 2 एसओ 4 ।
उपयोग: विलायक के रूप में, एंटीसेप्टिक (टिंचर आयोडीन) के रूप में, ऑटोमोबाइल में एंटी-फ्रीज के रूप में।
एथेनोइक एसिड ( CH3COOH ): आमतौर पर एसिटिक एसिड के रूप में जाना जाता है। पानी में 5-8% एथेनोइक एसिड को सिरका कहा जाता है। शुद्ध एथेनोइक एसिड का गलनांक 290 K होता है और इसलिए, यह अक्सर ठंडी जलवायु में जम जाता है इसलिए इसे ग्लेशियल एसिटिक एसिड कहा जाता है।
भौतिक गुण
- यह एक रंगहीन, तीखी गंध वाला द्रव है।
- सभी अनुपातों में पानी के साथ विलेयशील।
- नीले लिटमस पत्र को लाल कर देता है।
रासायनिक गुण
(i) एस्टरीफिकेशन रिएक्शन: सांद्र की कुछ बूंदों की उपस्थिति में अल्कोहल के साथ एथेनोइक एसिड की प्रतिक्रिया। उत्प्रेरक के रूप में एच 2 एसओ 4 एस्टर के रूप में जाना जाने वाला एक सुगंधित पदार्थ देता है, जिसे एस्टरीफिकेशन प्रतिक्रिया कहा जाता है।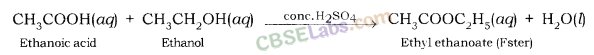
एस्टर का उपयोग परफ्यूम और फ्लेवरिंग एजेंट बनाने में किया जाता है।
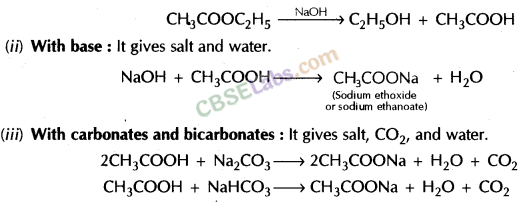
सैपोनिफिकेशन रिएक्शन: सोडियम हाइड्रॉक्साइड के साथ एस्टर की प्रतिक्रिया, कार्बोक्जिलिक एसिड (साबुन) का अल्कोहल और सोडियम नमक देता है। इस प्रतिक्रिया को सैपोनिफिकेशन रिएक्शन के रूप में जाना जाता है।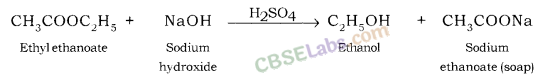
(ii) कार्बोनेट और हाइड्रोजन कार्बोनेट के साथ अभिक्रियाः एथेनोइक अम्ल सोडियम कार्बोनेट और सोडियम हाइड्रोजन कार्बोनेट से अभिक्रिया करके लवण, कार्बन डाइऑक्साइड और जल बनाता है।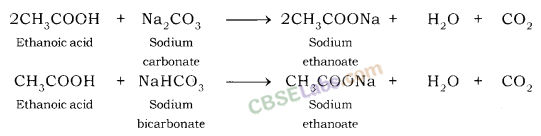
- सिरका के रूप में प्रयोग किया जाता है।
- एसिटाइल क्लोराइड और एस्टर की तैयारी के लिए कच्चे माल के रूप में उपयोग किया जाता है।
साबुन: लंबी श्रृंखला वाले वसीय अम्लों के सोडियम या पोटैशियम लवण साबुन कहलाते हैं।
सामान्य सूत्र: आरसीओओ - ना +
अपमार्जक (Detergent) लंबी श्रृंखला वाले वसा अम्लों के अमोनियम तथा सल्फोनेट लवण अपमार्जक कहलाते हैं।
उदाहरण: सीएच 3 —(सीएच 2 ) 11 —सी 6 एच 4 —एसओ 3 ना।
कठोर और मृदु जल: वह जल जो साबुन के साथ आसानी से झाग नहीं देता है कठोर जल कहलाता है और जो साबुन के साथ झाग उत्पन्न करता है, मृदु जल कहलाता है।
पानी की कठोरता कैल्शियम और मैग्नीशियम के बाइकार्बोनेट, क्लोराइड और सल्फेट नमक की उपस्थिति के कारण होती है।
साबुन और अपमार्जक में अंतर
| साबुन | डिटर्जेंट |
| (i) ये लंबी श्रृंखला वाले वसीय अम्लों के सोडियम या पोटैशियम लवण होते हैं। | (i) ये लंबी श्रृंखला वाले फैटी एसिड के अमोनियम और सल्फोनेट लवण हैं। |
| (ii) साबुन का आयनिक भाग —COO – Na + होता है | (ii) अपमार्जक का आयनिक भाग -OSO3- Na + होता है । |
| (iii) कठोर जल में इनकी कार्यक्षमता घट जाती है | (iii) कठोर जल में उनकी दक्षता अप्रभावित रहती है। |
| (iv) साबुन जैव निम्नीकरणीय होते हैं। | (iv) अपमार्जक अजैव निम्नीकरणीय होते हैं। |
अपमार्जकों के लाभ साबुन की तुलना में अपमार्जक का मुख्य लाभ यह है कि साबुनों को धोने के लिए कठोर जल में प्रयोग नहीं किया जा सकता क्योंकि कठोर जल साबुन से अभिक्रिया कर गाढ़ा सफेद अवक्षेप बनाता है जिसे मैल कहते हैं।
अतः कठोर जल में साबुन झाग नहीं देता जबकि डिटर्जेंट झाग देता है।
साबुन और डिटर्जेंट की सफाई क्रिया: साबुन और डिटर्जेंट दोनों में दो भाग होते हैं। एक लंबा हाइड्रोकार्बन भाग जो प्रकृति में हाइड्रोफोबिक (जल विकर्षक) है और एक छोटा आयनिक भाग जो प्रकृति में हाइड्रोफिलिक (जल को आकर्षित करने वाला) है।
साबुन के अणु का हाइड्रोकार्बन हिस्सा खुद को तैलीय (गंदगी) बूंद से जोड़ता है और आयनिक सिरा खुद को पानी की ओर उन्मुख करता है और एक गोलाकार संरचना बनाता है जिसे मिसेल कहते हैं। साबुन के मिसेल गंदगी को पानी में घोलने और हमारे कपड़े धोने में मदद करते हैं।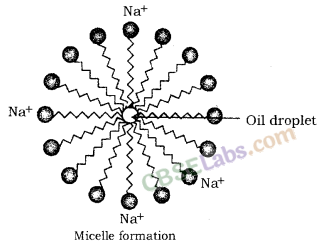
सहसंयोजक बंधन: दो परमाणुओं के बीच वैलेंस इलेक्ट्रॉनों को साझा करके दो परमाणुओं के बीच एक रासायनिक बंधन बनता है ताकि प्रत्येक परमाणु निकटतम महान गैस के स्थिर इलेक्ट्रॉनिक विन्यास को प्राप्त कर सके।
सहसंयोजकता: साझा करने के लिए प्रत्येक परमाणु द्वारा योगदान किए गए इलेक्ट्रॉनों की संख्या।
कार्बन हमेशा एक सहसंयोजक बंधन बनाता है: कार्बन की परमाणु संख्या 6 है। इसलिए, इसका विन्यास K-2, L-4 है। इसलिए, उत्कृष्ट गैस विन्यास प्राप्त करने और स्थिर होने के लिए इसे या तो 4 इलेक्ट्रॉनों को खोना या प्राप्त करना चाहिए।
हालाँकि, निम्नलिखित कारणों से कार्बन के लिए चार इलेक्ट्रॉनों को प्राप्त करना या खोना कठिन है:
- यह नियॉन गैस (2, 8) विन्यास वाले C 4- आयन बनाने के लिए 4 इलेक्ट्रॉनों को प्राप्त नहीं कर सकता है क्योंकि चार इलेक्ट्रॉनों को जोड़े जाने और छह इलेक्ट्रॉनों के बीच प्रतिकर्षण की शक्तियों को दूर करने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता के कारण यह आयन अत्यधिक अस्थिर होगा। इलेक्ट्रॉन पहले से ही कार्बन परमाणु में मौजूद हैं।
- हीलियम गैस (2) विन्यास वाले C 4+ आयन बनाने के लिए यह 4 इलेक्ट्रॉनों को नहीं खो सकता है क्योंकि कार्बन परमाणु से चार इलेक्ट्रॉनों को निकालने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता के कारण यह धनायन अत्यधिक अस्थिर होगा।
कार्बन की टेट्रावैलेंसी: एक कार्बन परमाणु के वैलेंस शेल में चार इलेक्ट्रॉन होते हैं। इसलिए, कार्बन चार सहसंयोजक बंध बनाता है, अर्थात कार्बन टेट्रावैलेंट है।
कार्बन के अपरूप रूप: किसी तत्व के दो या दो से अधिक रूपों में अस्तित्व की घटना जिसमें अलग-अलग भौतिक गुण होते हैं लेकिन रासायनिक गुण समान होते हैं, अपररूप कहलाते हैं।
कार्बन के तीन अपररूप:
- हीरा
- सीसा
- फुलरीन
हाइड्रोकार्बन: कार्बन और हाइड्रोजन के कार्बनिक यौगिकों को हाइड्रोकार्बन कहा जाता है।
संतृप्त यौगिक: कार्बन के वे यौगिक जिनमें कार्बन परमाणुओं के बीच केवल एक आबंध होता है, संतृप्त यौगिक कहलाते हैं, जैसे एथेन, प्रोपेन, ब्यूटेन आदि।
असंतृप्त यौगिक: कार्बन के वे यौगिक जिनमें कार्बन परमाणुओं के बीच एक या अधिक द्वि या त्रिक बंध होते हैं, असंतृप्त यौगिक कहलाते हैं
, जैसे एथीन, प्रोपीन, ब्यूटेन आदि।
हाइड्रोकार्बन
- सामान्य सूत्र - C n H 2n+2
- संतृप्त हाइड्रोकार्बन
- मीथेन - सीएच 4
- ईथेन - सी 2 एच 6
Alkenes
- सामान्य सूत्र - सी एन एच 2 एन
- असंतृप्त हाइड्रोकार्बन।
- एथीन - सी 2 एच 4
- प्रोपेन - सी 3 एच 6
सजातीय श्रृंखला: समान कार्यात्मक समूह, समान रासायनिक गुणों और क्रमिक (आसन्न) सदस्यों वाले कार्बनिक यौगिकों का एक परिवार CH 2 इकाई या 14 द्रव्यमान इकाई से भिन्न होता है।
सजातीय श्रेणी की विशेषताएँ: सजातीय श्रेणी
के सभी सदस्यों को एक सामान्य सूत्र द्वारा दर्शाया जा सकता है।
- अल्केन - सी एन एच 2n+2
- अल्काइन - सी एन एच 2n-2
- एल्कोहल - C n H 2n+1 OH
- केटोन - सी एन एच 2n + 1 सीओसी एन एच 2 एन + 1
- अल्केन - सी एन एच 2 एन
- हेलोऐल्केन - C n H 2n+1 X
- एल्डिहाइड - सी एन एच 2n + 1 सी एच ओ
- कार्बोक्जिलिक एसिड - सी एन एच 2n + 1 सीओओएच
एक सजातीय श्रृंखला के दो क्रमिक (आसन्न) सदस्यों का आणविक सूत्र CH 2 इकाई से भिन्न होता है।
किसी सजातीय श्रेणी के किन्हीं दो क्रमिक सदस्यों के आण्विक द्रव्यमान में 14 u का अंतर होता है।
किसी दी गई सजातीय श्रेणी के सभी सदस्यों का एक ही प्रकार्यात्मक समूह होता है।
किसी श्रेणी के सभी सदस्य समान रासायनिक गुण प्रदर्शित करते हैं।
सजातीय श्रेणी के सदस्य भौतिक गुणों में श्रेणीक्रम प्रदर्शित करते हैं।
कार्बन यौगिक का नामकरण: इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) ने कार्बन यौगिकों के नामकरण के लिए कुछ नियम तय किए। यह दुनिया भर में एकरूपता बनाए रखने के लिए किया गया था। इस आधार पर जो नाम दिए जाते हैं, उन्हें लोकप्रिय रूप से IUPAC नाम से जाना जाता है। नामकरण के नियम इस प्रकार हैं:
(i) कार्बन यौगिक में कार्बन परमाणुओं की संख्या की पहचान करें। कार्बन परमाणुओं की संख्या के अनुसार कार्बन यौगिकों के नाम लिखिए।
उदाहरण, एक कार्बन परमाणु वाले संतृप्त हाइड्रोकार्बन को मीथेन नाम दिया गया है। दो कार्बन परमाणुओं वाले संतृप्त हाइड्रोकार्बन को ईथेन नाम दिया गया है।
- दो कार्बन परमाणुओं वाले दोहरे बंधन वाले असंतृप्त हाइड्रोकार्बन को एथीन नाम दिया गया है।
- कार्बन परमाणुओं के बीच ट्रिपल बॉन्ड वाले असंतृप्त हाइड्रोकार्बन को एथाइन नाम दिया गया है।
(ii) यदि संरचना में शाखित श्रृंखला है, तो सबसे लंबी श्रृंखला की पहचान करें और फिर कार्बन परमाणुओं की संख्या की पहचान करें।
(iii) प्रकार्यात्मक समूह की उपस्थिति की स्थिति में क्रियात्मक समूह के उपसर्ग या प्रत्यय को नीचे दिए अनुसार लिखिए। फिर मूल यौगिक का नाम लिखें:
इथेनॉल के रासायनिक गुण
- इथेनॉल (C2H5OH ) यौगिक कमरे के तापमान पर एक रंगहीन तरल है । यह अल्कोहल की सजातीय श्रृंखला का दूसरा सदस्य है। इसका सामान्य नाम एथिल अल्कोहल है। इसका क्रियात्मक समूह है - OH।
- इसमें बहुत कम गलनांक (156 K) और कम क्वथनांक (351 K या 78 ° C) होता है।
- इथेनॉल पानी में अत्यधिक घुलनशील है।
- इथेनॉल मादक पेय के मुख्य घटकों में से एक है।
- यह एक अच्छा कार्बनिक विलायक है।
- यह एक उदासीन पदार्थ है, इसलिए नीले लिटमस विलयन या लाल लिटमस विलयन पर इसका कोई प्रभाव नहीं पड़ता है।
- यह वायु की O2 की उपस्थिति में नीली ज्वाला से जलता है । यह दहन एक ऑक्सीकरण प्रक्रिया है।

- क्षारीय KMnO4 की उपस्थिति में यह एथेनोइक अम्ल में ऑक्सीकृत हो जाता है।
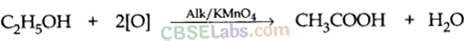
- इथेनॉल अल्कोहल सोडियम एथोक्साइड बनाने के लिए सोडियम (Na) धातु के साथ तेजी से प्रतिक्रिया करता है और H2 गैस विकसित करता है।
2C 2 H 5 OH + 2Na → 2C 2 H 5 ONa (सोडियम एथोक्साइड) + H 2 (छ) - शंकु की उपस्थिति में निर्जलीकरण पर इथेनॉल। H2SO4 अम्ल 443 K पर एथीन गैस बनाता है । H2SO4 एसिड अल्कोहल के अणुओं से पानी के अणुओं को अवशोषित करता है और एक मजबूत निर्जलीकरण एजेंट के रूप में कार्य करता है ।
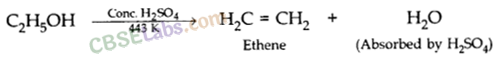
एथेनोइक एसिड के रासायनिक गुण
- एथेनोइक एसिड जिसे आमतौर पर एसिटिक एसिड ( CH3COOH ) कहा जाता है, एक रंगहीन तरल है। इसमें मौजूद कार्यात्मक समूह कार्बोक्जिलिक एसिड - COOH है।
- इसका गलनांक 290 K तथा क्वथनांक 391 K होता है।
- अम्ल होने के कारण यह नीले लिटमस को लाल कर देता है।
- यह स्वाद में खट्टा होता है।
- शंकु की उपस्थिति में एथेनोइक एसिड अल्कोहल के साथ प्रतिक्रिया करता है। H2SO4 अम्ल एस्टर नामक मीठी महक वाले यौगिक बनाने के लिए ।
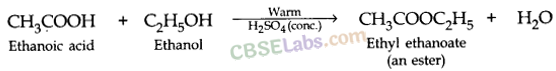
- एथेनोइक अम्ल क्षारों से अभिक्रिया कर लवण और जल बनाता है।
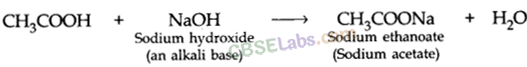
- यह धातुओं के कार्बोनेट और हाइड्रोजन-कार्बोनेट यौगिकों के साथ प्रतिक्रिया करके अपना नमक बनाता है (सोडियम इथेनोएट जिसे आमतौर पर सोडियम एसीटेट कहा जाता है) और सीओ 2 गैस छोड़ता है।
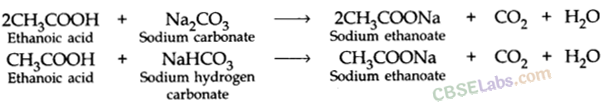
साबुन की सफाई की क्रिया: आमतौर पर गंदगी गंदे कपड़े की सतह पर तेल या ग्रीस की पतली परत से चिपकी रहती है।
जब एक गंदे कपड़े को साबुन या डिटर्जेंट के घोल से उपचारित किया जाता है, तो साबुन की गैर-ध्रुवीय पूंछ या डिटर्जेंट तेल या ग्रीस में घुल जाता है जबकि ध्रुवीय सिर आसपास के पानी से जकड़े रहते हैं। साबुन या डिटर्जेंट मिसेल उनके केंद्र में पड़ी तैलीय या चिकना गंदगी से बनता है (साबुन या डिटर्जेंट चिकना गंदगी और पानी दोनों से आकर्षित होता है।
जब कपड़े की सतह को यांत्रिक रूप से रगड़ा जाता है या पत्थर पर या लकड़ी के पैडल से पीटा जाता है या वाशिंग मशीन में हिलाया जाता है, तो गंदे सतह से ढीले तैलीय कण को हटाया जाता है और कपड़े को साफ किया जाता है। डिटर्जेंट साबुन की तुलना में पानी के पृष्ठ तनाव को काफी हद तक कम कर देता है, इसलिए डिटर्जेंट की सफाई की क्रिया साबुन की तुलना में बहुत अधिक होती है।
1. पृथ्वी की पपड़ी में खनिजों के रूप में केवल 0.02% कार्बन है (जैसे कार्बोनेट्स ^ बाइकार्बोनेट, कोयला और पेट्रोलियम)।
2. वायुमंडल में 0.03% कार्बन डाइऑक्साइड है।
3. प्रकृति में कम मात्रा में उपलब्ध होने के बावजूद, कार्बन एक बहुमुखी तत्व है क्योंकि यह सभी जीवित जीवों और कई चीजों के लिए आधार बनाता है जिनका हम उपयोग करते हैं।
4. कार्बन में आबंधन :
- कार्बन की परमाणु संख्या = 6
- एक इलेक्ट्रॉनिक विन्यास में K कोश में 2 इलेक्ट्रॉन और L कोश में 4 इलेक्ट्रॉन होते हैं।
- उत्कृष्ट गैस विन्यास प्राप्त करने के लिए, कार्बन को या तो 4 इलेक्ट्रॉन प्राप्त करने चाहिए या 4 इलेक्ट्रॉन खोने चाहिए या अपने 4 इलेक्ट्रॉनों को किसी अन्य तत्व के साथ साझा करना चाहिए।
- 4 इलेक्ट्रॉनों का लाभ (एक ऑक्टेट बनाने के लिए, यानी C 4- ऋणायन में 8 इलेक्ट्रॉन) मुश्किल है क्योंकि तब 6 प्रोटॉन वाले एक नाभिक को अतिरिक्त चार इलेक्ट्रॉनों को धारण करना होगा।
- 4 इलेक्ट्रॉनों की हानि (डुप्लेट प्राप्त करने के लिए, अर्थात, C 4+ धनायन में He परमाणु जैसे 2 इलेक्ट्रॉन) मुश्किल है क्योंकि इसमें चार इलेक्ट्रॉनों को निकालने के लिए बड़ी मात्रा में ऊर्जा की आवश्यकता होती है।
- कार्बन, इसलिए, कार्बन के अन्य परमाणुओं या अन्य तत्वों के परमाणुओं के साथ अपने चार वैलेंस इलेक्ट्रॉनों को साझा करके इस कठिनाई को दूर करता है। इन इलेक्ट्रॉनों को परमाणुओं द्वारा परस्पर साझा करने के लिए स्थिर महान गैस विन्यास प्राप्त करने के लिए योगदान दिया जाता है, उस परमाणु की सहसंयोजकता कहलाती है। अतः कार्बन TETRACOVALENCY दर्शाता है।
- इलेक्ट्रॉनों (यानी, सहसंयोजक बंधन) के साझाकरण से बनने वाले सबसे सरल अणु को इलेक्ट्रॉन बिंदु संरचना द्वारा दर्शाया जा सकता है।
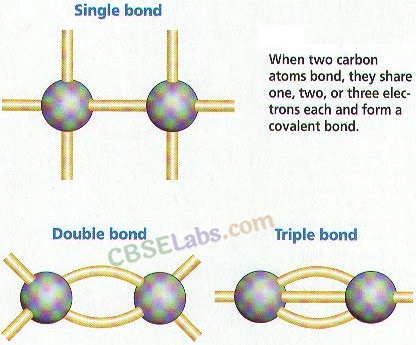
5. कार्बन के अपरूप: वह परिघटना जिसके द्वारा कोई तत्व दो या दो से अधिक रूपों में मौजूद हो सकता है, समान रासायनिक गुणों के साथ लेकिन विभिन्न भौतिक गुणों को अपररूप कहा जाता है और विभिन्न रूपों को अपररूप कहा जाता है। कार्बन तीन अपरूपों को प्रदर्शित करता है :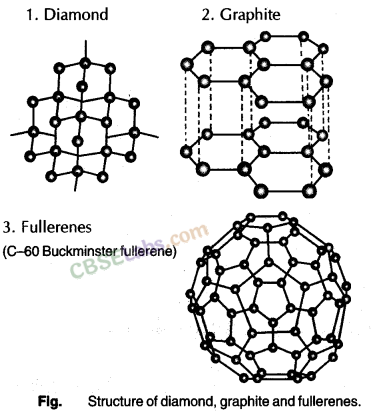
नोट:
- हीरा सबसे कठोर पदार्थ होता है जबकि ग्रेफाइट बहुत मुलायम होता है।
- हीरा कठोर पदार्थों को पीसने और चमकाने के काम आता है और ग्रेफाइट स्नेहक के रूप में प्रयोग किया जाता है।
- हीरे की त्रि-आयामी कठोर संरचना होती है लेकिन ग्रेफाइट में हेक्सागोनल शीट परत संरचना होती है।
- हीरा विद्युत का कुचालक होता है जबकि ग्रेफाइट विद्युत का बहुत अच्छा चालक होता है।
6. फुलरीन: कार्बन एलोट्रोप की एक नई श्रेणी, फुलरीन आकार में गोलाकार या सॉकर बॉल की तरह होती है। पहली फुलरीन की पहचान C-60 थी जिसमें 60 कार्बन परमाणु थे, जो अमेरिकी वास्तुकार, बकमिनस्टर फुलर द्वारा डिजाइन किए गए जियोडेसिक गुंबद की तरह व्यवस्थित थे, इसलिए इन्हें बकमिनस्टर फुलरीन या बकी बॉल संरचनाओं के रूप में भी जाना जाता है।
7. कार्बन की बहुमुखी प्रकृति के कारण कार्बन की बहुमुखी प्रकृति के चार मुख्य कारण हैं
: , या विभिन्न आकारों के छल्ले (जैसा कि नीचे दिखाया गया है):
(बी) टेट्राकोवलेंसी: छोटे आकार और चार वैलेंस इलेक्ट्रॉनों की उपस्थिति के कारण, कार्बन अन्य कार्बन परमाणुओं, हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, या सल्फर, आदि के साथ मजबूत बंधन बना सकता है। उदाहरण के लिए, हाइड्रोजन के साथ कार्बन के यौगिकों को हाइड्रोकार्बन कहा जाता है।
(c) मल्टीपल बॉन्ड फॉर्मेशन: कार्बन का छोटा आकार भी इसे अन्य तत्वों के साथ-साथ अपने परमाणुओं के साथ कई बॉन्ड, (यानी, डबल बॉन्ड या ट्रिपल बॉन्ड) बनाने में सक्षम बनाता है। इससे कार्बन यौगिकों की संख्या में वृद्धि होती है।
टिप्पणी:
- कार्बन के दोहरे बंधन और ट्रिपल बांड वाले यौगिकों को असंतृप्त यौगिक कहा जाता है जबकि कार्बन-कार्बन एकल बांड वाले को संतृप्त यौगिक कहा जाता है।
- अल्केन्स (—C = C— के साथ) और एल्काइन्स (—C = C— के साथ) असंतृप्त होते हैं, जबकि एल्केन्स (—C — C— के साथ) संतृप्त यौगिक होते हैं।
(d) समावयवता (Isomerism): वह परिघटना जिसके द्वारा एक ही आणविक सूत्र वाले कार्बन यौगिक विभिन्न संरचनाएँ और गुण दिखाते हैं, उदाहरण के लिए, 4 कार्बन परमाणुओं की एक श्रृंखला को दो तरह से लिखा जा सकता है: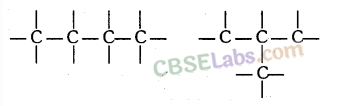
इसलिए, कार्बन यौगिकों की संख्या बढ़कर एक हो जाती है। बड़ी संख्या।
8. हाइड्रोकार्बन: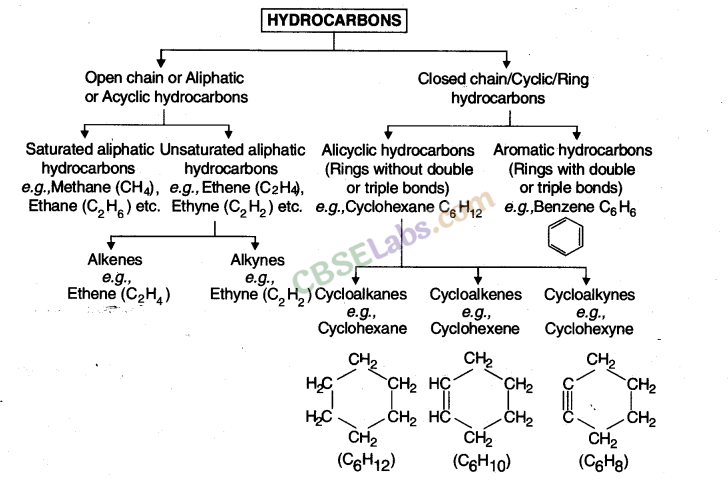
बड़ी संख्या में हाइड्रोकार्बन को वर्गीकृत किया जा सकता है: श्रृंखला :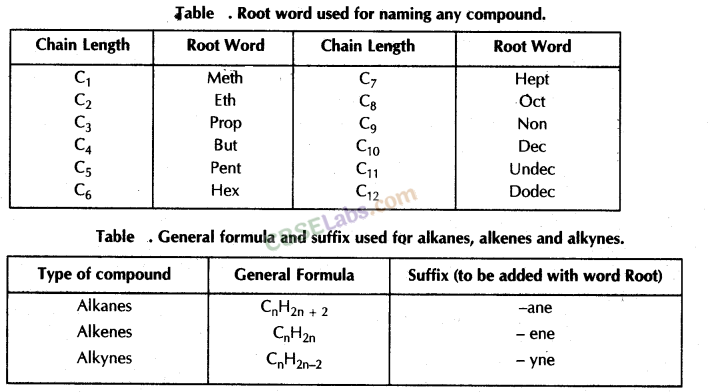
महत्वपूर्ण: एकल कार्बन परमाणु के साथ कोई एल्कीन या एल्कीन संभव नहीं है क्योंकि कार्बन और हाइड्रोजन परमाणु के बीच दोहरा या तिहरा बंधन संभव नहीं है। यह केवल दो कार्बन परमाणुओं के बीच है।
9. कार्यात्मक समूह:
- एक परमाणु या परमाणुओं का समूह जो किसी यौगिक में उपस्थित होने पर उसे विशिष्ट गुण प्रदान करता है, एक कार्यात्मक समूह कहलाता है।
- क्रियात्मक समूह के साथ दिखाई गई एकल रेखा को इसकी मुक्त संयोजकता कहते हैं जिसके द्वारा यह एक हाइड्रोजन परमाणु या परमाणुओं, जैसे -Cl को प्रतिस्थापित करके एक यौगिक से जुड़ जाती है।
- क्रियात्मक समूह, जो हाइड्रोजन को प्रतिस्थापित करता है, को विषम परमाणु भी कहा जाता है क्योंकि यह कार्बन से भिन्न होता है, और नाइट्रोजन, सल्फर, या हलोजन आदि हो सकता है।
महत्वपूर्ण: एक कार्यात्मक समूह द्वारा हाइड्रोजन परमाणु का प्रतिस्थापन हमेशा इस तरह से होता है कि कार्बन की संयोजकता संतुष्ट रहती है।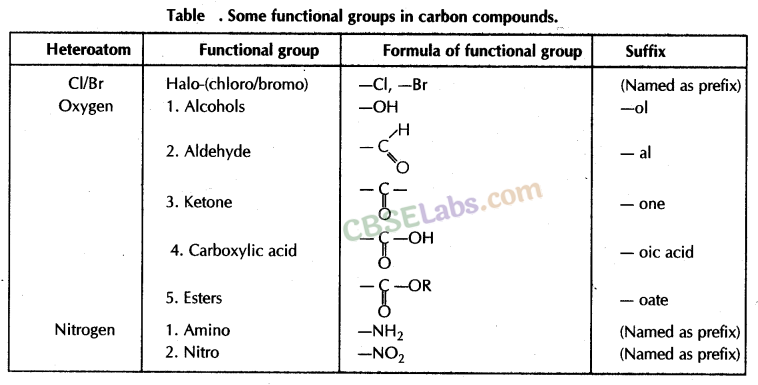
नोट: Cl को उपसर्ग क्लोरो के रूप में नामित किया गया है; ब्रो ब्रोमो के रूप में; एनएच 2 अमीनो के रूप में और एन0 2 नाइट्रो के रूप में।
महत्वपूर्ण नोट: सूत्र में प्रतीक 'आर' एक अल्काइल समूह का प्रतिनिधित्व करता है जो अल्केन से एक हाइड्रोजन परमाणु को हटाने से बनता है।
10. समजातीय श्रेणी: कार्बनिक यौगिकों की एक श्रृंखला जिसमें प्रत्येक बाद वाला सदस्य पिछले सदस्य से -CH2 समूह या 14 amu से भिन्न होता है। लेकिन रासायनिक गुण जो केवल एक कार्यात्मक समूह द्वारा निर्धारित होते हैं, एक श्रृंखला के भीतर समान रहते हैं।
11. कार्बनिक यौगिकों का नामकरण
- तुच्छ या सामान्य नाम: ये नाम उस स्रोत के नाम पर दिए गए थे जिससे कार्बनिक यौगिकों को पहले अलग किया गया था, उदाहरण के लिए, यदि एक यौगिक में एक कार्बन परमाणु होता है, तो इसके सामान्य नाम का मूल शब्द रूप होगा और इसी तरह (तालिका देखें)।
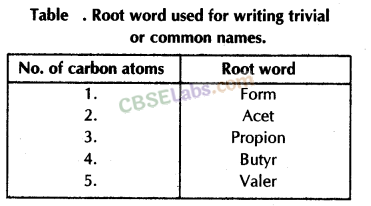
- IUPAC नाम: इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री ने विभिन्न यौगिकों के नामकरण के लिए निम्नलिखित नियम दिए:
- कार्बन परमाणुओं की संख्या की पहचान करें और उसके अनुरूप शब्द रूट लिखें। उदाहरण के लिए, यदि कार्बन परमाणुओं की संख्या तीन है, तो रूट शब्द एक सहारा है।
- एक कार्यात्मक समूह की उपस्थिति तालिका 2 और तालिका 3 में दिए गए उपसर्ग या प्रत्यय द्वारा इंगित की जाती है।
- यदि क्रियात्मक समूह का नाम प्रत्यय के रूप में देना हो तो यौगिक के नाम के अन्तिम अक्षर 'ई' को हटाकर प्रत्यय लगा दिया जाता है। उदाहरण के लिए, तीन कार्बन परमाणुओं वाले कीटोन का नाम इस प्रकार रखा गया है:
प्रोपेन - ई = प्रोपेन + 'वन' = प्रोपेनोन। तीन कार्बन वाली शराब प्रोपेनॉल है। तीन कार्बन वाला कार्बोक्जिलिक एसिड प्रोपेनोइक एसिड है। - IUPAC में हैलोजेन को उपसर्ग के रूप में लिखा जाता है, उदाहरण के लिए, दो कार्बन और एक क्लोरो समूह वाले यौगिक को क्लोरोइथेन (CH 3 CH 2 CI) नाम दिया गया है।
12. कार्बन यौगिकों के रासायनिक गुण: कार्बन यौगिकों
के मुख्य गुण हैं:
(ए) दहन प्रतिक्रिया
(बी) ऑक्सीकरण प्रतिक्रिया
(सी) अतिरिक्त प्रतिक्रिया।
(डी) प्रतिस्थापन प्रतिक्रिया
(ए) दहन प्रतिक्रिया: एक रासायनिक प्रतिक्रिया जिसमें कोई पदार्थ हवा या ऑक्सीजन की उपस्थिति में जलता है, दहन प्रतिक्रिया कहलाती है।
नोट: दहन हमेशा एक एक्ज़ोथिर्मिक प्रतिक्रिया होती है, उदाहरण के लिए,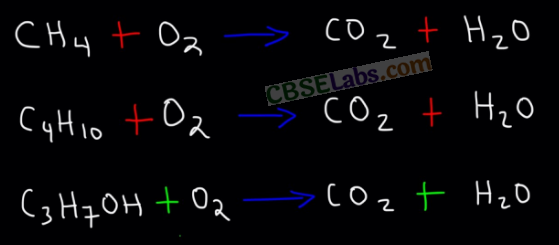
याद रखें:
- संतृप्त हाइड्रोकार्बन आम तौर पर स्वच्छ ज्वाला देते हैं जबकि असंतृप्त हाइड्रोकार्बन राख जैसी ज्वाला देते हैं (क्योंकि इनमें कार्बन की मात्रा हाइड्रोजन की मात्रा से अधिक होती है और इसलिए कार्बन अधूरा दहन दिखाता है और कालिख के रूप में दिखाई देता है)।
- संतृप्त हाइड्रोकार्बन ऑक्सीजन की सीमित आपूर्ति में कालिख की ज्वाला दे सकते हैं।
(बी) ऑक्सीकरण प्रतिक्रिया: दहन पर एक यौगिक में ऑक्सीजन के योग को ऑक्सीकरण कहा जाता है।
दहन के अलावा, ऑक्सीकरण भी हो सकता है: कुछ पदार्थों द्वारा लाया जाता है जो
दूसरों को ऑक्सीजन देने में सक्षम होते हैं, अर्थात, ऑक्सीकरण एजेंट, उदाहरण के लिए, अम्लीय K2 Cr 2 0 7 (पोटेशियम डाइक्रोमेट) और क्षारीय KMn0 4 ( पोटेशियम परमैंगनेट) .
टिप्पणी: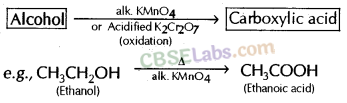
(c) संकलन अभिक्रिया: संतृप्त यौगिक देने के लिए उत्प्रेरक की उपस्थिति में असंतृप्त यौगिकों में एक अणु का योग एक योगात्मक अभिक्रिया कहलाती है, उदाहरण के लिए
वनस्पति तेलों का हाइड्रोजनीकरण जैसा कि नीचे अभिक्रिया में दिखाया गया है: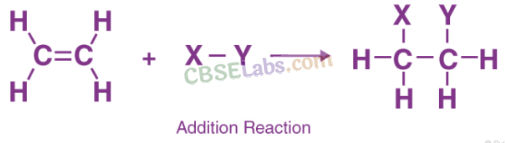
(डी) प्रतिस्थापन प्रतिक्रिया: ऐसी प्रतिक्रियाएं जिनमें अणु के शेष भाग में संरचना में कोई परिवर्तन किए बिना एक अणु से एक परमाणु या परमाणुओं के समूह को दूसरे परमाणु द्वारा प्रतिस्थापन शामिल होता है।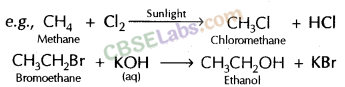
13. इथेनॉल: (या अल्कोहल)
रंगहीन तरल, पानी में घुलनशील, और इसमें एक अलग गंध और जलने का स्वाद होता है। कम मात्रा में इसका सेवन नशे का कारण बनता है और घातक हो सकता है।
14. एथेनोइक एसिड: CH3COOH सामान्य
नाम: एसिटिक एसिड।
पानी में एसिटिक एसिड के 5-8% घोल को सिरका कहा जाता है। और 100% शुद्ध एसिटिक एसिड को ग्लेशियल एसिटिक एसिड कहा जाता है क्योंकि इसमें m.pt होता है। 290 K और क्रिस्टल की तरह ग्लेशियर बनाने वाली जम जाती है। एथेनोइक
अम्ल की अभिक्रिया साबुनीकरण : अम्ल या क्षार की उपस्थिति में एस्टर अभिक्रिया कर पुनः ऐल्कोहॉल प्रदान करते हैं तथा कार्बोक्सिलिक अम्ल साबुनीकरण कहलाता है।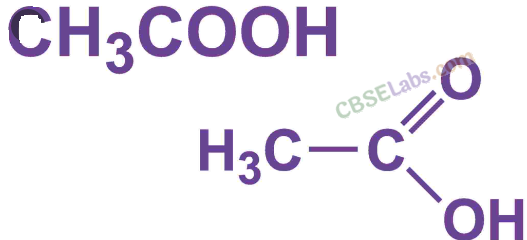
15. साबुन और अपमार्जक :
साबुन और संश्लिष्ट अपमार्जक : साबुन और अपमार्जक वे पदार्थ हैं जिनका उपयोग सफाई में किया जाता है।
साबुन: साबुन उच्च वसीय अम्लों के सोडियम या पोटैशियम लवण होते हैं, जैसे ओलिक अम्ल ( C17H33COOH ) , स्टीयरिक अम्ल ( C17H35COOH ) , पामिटिक अम्ल ( C15H31COOH ) , आदि । ये अम्ल हैं ग्लिसरॉल (तीन हाइड्रॉक्सिल समूह युक्त अल्कोहल) के साथ उनके एस्टर के रूप में मौजूद होते हैं। ये एस्टर, जिन्हें 'ग्लिसराइड्स' कहा जाता है, पशु और वनस्पति मूल के वसा और तेलों में मौजूद होते हैं।
साबुन का निर्माणः जब किसी तेल या वसा (ग्लिसराइड) को सोडियम हाइड्रॉक्साइड विलयन से अभिकृत किया जाता है तो यह अम्ल (साबुन) और ग्लिसरॉल के सोडियम लवण में परिवर्तित हो जाता है। प्रतिक्रिया साबुनीकरण के रूप में जाना जाता है।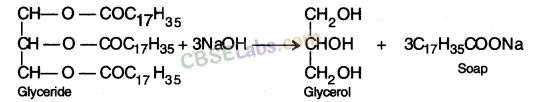
डिटर्जेंट: रासायनिक रूप से, डिटर्जेंट सल्फोनिक एसिड के सोडियम लवण होते हैं, यानी, डिटर्जेंट में हाइड्रोकार्बन के एक सिरे पर एक कार्बोक्जिलिक एसिड समूह (—COOH) के बजाय एक सल्फोनिक एसिड समूह (-S0 3 H) होता है।
साबुन की तुलना में डिटर्जेंट की सफाई क्रिया अधिक प्रभावी मानी जाती है।
साबुन और अपमार्जक की सफाई क्रिया: साबुन और अपमार्जक की सफाई क्रिया इसी सिद्धांत का पालन करती है।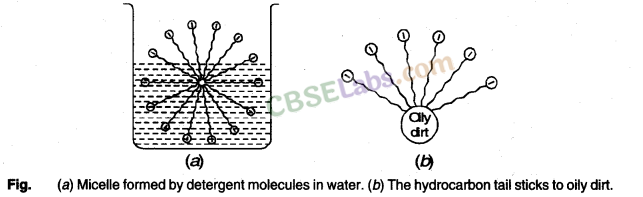
जब साबुन या डिटर्जेंट को पानी में घोला जाता है, तो अणु गुच्छों के रूप में एक साथ इकट्ठा होते हैं, जिन्हें मिसेल कहा जाता है। पूंछ अंदर की ओर और सिर बाहर की ओर चिपके रहते हैं।
सफाई में, हाइड्रोकार्बन पूंछ खुद को तैलीय गंदगी से जोड़ लेती है। जब पानी उत्तेजित होता है, तो तैलीय गंदगी गंदी सतह से ऊपर उठ जाती है और टुकड़ों में बिखर जाती है। यह अन्य पूंछों को तेल से चिपकने का अवसर देता है। समाधान में अब डिटर्जेंट अणुओं से घिरे तेल के छोटे ग्लोब्यूल होते हैं। पानी में मौजूद ऋणात्मक रूप से आवेशित सिर छोटे ग्लोब्यूल्स को एक साथ आने से रोकते हैं और समुच्चय बनाते हैं। इस प्रकार, तैलीय गंदगी वस्तु से दूर हो जाती है।
16. झाग (स्कम) : कठोर जल में उपस्थित कैल्सियम तथा मैग्नीशियम आयनों के साथ अभिक्रिया करने पर साबुन के अणु द्वारा बनने वाले अघुलनशील अवक्षेप। इससे बहुत सारा साबुन बर्बाद हो जाता है और सफाई की क्रिया काफी हद तक कम हो जाती है।




0 Comments