संकेतक: संकेतक वे पदार्थ होते हैं जो रंग परिवर्तन द्वारा विलयन की अम्लीय या क्षारीय प्रकृति का संकेत देते हैं।
संकेतक के प्रकार : संकेतक कई प्रकार के होते हैं। कुछ सामान्य प्रकार के संकेतक हैं:
1. प्राकृतिक संकेतक: प्राकृतिक स्रोतों से प्राप्त संकेतक प्राकृतिक संकेतक कहलाते हैं। लिटमस, हल्दी, लाल पत्तागोभी, चाइना रोज आदि कुछ सामान्य प्राकृतिक सूचक हैं जिनका प्रयोग व्यापक रूप से पदार्थों के अम्लीय या क्षारकीय गुणों को दर्शाने के लिए किया जाता है।
लिटमस: लिटमस को लाइकेन से प्राप्त किया जाता है। लिटमस का विलयन बैंगनी रंग का होता है। लिटमस पेपर दो रंगों में आता है- नीला और लाल।
अम्ल नीले लिटमस पत्र को लाल कर देता है।
एक आधार लाल लिटमस पेपर को नीला कर देता है।
हल्दी: हल्दी एक अन्य प्राकृतिक सूचक है। हल्दी पीले रंग की होती है। हल्दी का घोल या कागज बेस के साथ लाल भूरे रंग का हो जाता है। हल्दी अम्ल से रंग नहीं बदलती।
लाल गोभी: लाल गोभी का रस मूल रूप से बैंगनी रंग का होता है। लाल गोभी का रस अम्ल से लाल और क्षार से हरा हो जाता है।
2. घ्राण सूचक- ऐसे पदार्थ जो अम्ल या क्षार के साथ मिलने पर अपनी गंध बदल लेते हैं, घ्राण सूचक कहलाते हैं। उदाहरण के लिए; प्याज, वैनिला आदि।
प्याज : प्याज का पेस्ट या रस बेस के साथ मिलाने पर उसकी महक चली जाती है। अम्ल से इसकी गंध नहीं बदलती।
वैनिला: वैनिला की महक क्षार के साथ गायब हो जाती है, लेकिन इसकी गंध एक एसिड के साथ गायब नहीं होती है।
प्रयोगशाला में दृष्टिबाधित छात्रों की भागीदारी सुनिश्चित करने के लिए घ्राण संकेतकों का उपयोग किया जाता है।
3. सिंथेटिक संकेतक: जो संकेतक प्रयोगशाला में संश्लेषित होते हैं उन्हें सिंथेटिक संकेतक के रूप में जाना जाता है। उदाहरण के लिए; फेनोल्फथेलिन, मिथाइल ऑरेंज आदि।
फेनोल्फथेलिन एक रंगहीन तरल है। यह अम्ल के साथ रंगहीन रहता है लेकिन क्षार के साथ गुलाबी हो जाता है।
मिथाइल ऑरेंज मूल रूप से नारंगी रंग का होता है। यह अम्ल के साथ लाल हो जाता है और क्षार के साथ पीला हो जाता है।
| सूचक | मूल रंग | अम्ल | आधार |
| लाल लिटमस | लाल | कोई परिवर्तन नहीं होता है | नीला |
| नीला लिटमस | नीला | लाल | कोई परिवर्तन नहीं होता है |
| हल्दी | पीला | कोई परिवर्तन नहीं होता है | लाल भूरे रंग |
| लाल गोभी का रस | बैंगनी | लाल | हरा सा पीला |
| phenolphthalein | बेरंग | बेरंग | गुलाबी |
| मिथाइल नारंगी | नारंगी | लाल | पीला |
| प्याज़ | लागू नहीं | कोई परिवर्तन नहीं होता है | गंध गायब हो जाती है |
| वनीला | लागू नहीं | कोई परिवर्तन नहीं होता है | गंध गायब हो जाती है |
अम्ल: अम्ल स्वाद में खट्टे होते हैं, नीले लिटमस को लाल कर देते हैं और जल में घुलकर H + आयन छोड़ते हैं।
उदाहरण: सल्फ्यूरिक एसिड (H2SO4 ) , एसिटिक एसिड ( CH3COOH ), नाइट्रिक एसिड (HNO3 ) आदि । एसिड के गुण :
- एसिड का स्वाद खट्टा होता है।
- नीले लिटमस को लाल कर देता है।
- अम्ल विलयन विद्युत का सुचालक होता है।
- जलीय घोल में H + आयन छोड़ें।
अम्लों के प्रकार: अम्लों को उनकी उपस्थिति के आधार पर दो प्रकारों में विभाजित किया जाता है, प्राकृतिक अम्ल और खनिज अम्ल।
(i) प्राकृतिक अम्ल: वे अम्ल जो प्राकृतिक स्रोतों से प्राप्त होते हैं, प्राकृतिक अम्ल या कार्बनिक अम्ल कहलाते हैं।
उदाहरण: मेथेनॉइक
एसिड (HCOOH) एसिटिक
एसिड ( CH3COOH ) ऑक्सालिक
एसिड ( C2H2O4 ) आदि ।
| कार्बनिक अम्ल और उनके स्रोत | |
| एसिड | सूत्रों का कहना है |
| सिरका अम्ल | सिरका |
| एस्कॉर्बिक अम्ल | अमरूद, आंवला |
| साइट्रिक एसिड | नींबू, संतरा और अन्य खट्टे फल |
| दुग्धाम्ल | खट्टा दूध, दही |
| मेथेनोइक एसिड | चींटी का डंक, बिछुआ का डंक |
| ऑक्सालिक एसिड | टमाटर |
| टारटरिक अम्ल | इमली |
(ii) खनिज अम्ल: खनिजों से तैयार होने वाले अम्लों को खनिज अम्ल कहा जाता है; अकार्बनिक एसिड, मानव निर्मित एसिड या सिंथेटिक एसिड को मिनरल एसिड के रूप में भी जाना जाता है।
उदाहरण: हाइड्रोक्लोरिक
एसिड (HCl) सल्फ्यूरिक
एसिड ( H2SO4 ) नाइट्रिक एसिड (HNO3 ) कार्बोनिक एसिड (H2CO3 ) फॉस्फोरिक एसिड (H3PO4 ) आदि ।
अम्ल के रासायनिक गुण:
(i) धातु के साथ अम्ल की प्रतिक्रिया: अम्ल जब धातु से अभिक्रिया करते हैं तो संबंधित लवण के साथ हाइड्रोजन गैस देते हैं।
धातु + अम्ल → लवण + हाइड्रोजन
उदाहरण:
जब हाइड्रोक्लोरिक अम्ल की जिंक धातु से अभिक्रिया होती है तो हाइड्रोजन गैस तथा जिंक क्लोराइड बनता है।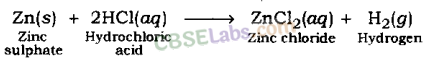
जब सल्फ्यूरिक अम्ल सोडियम धातु से अभिक्रिया करता है तो हाइड्रोजन गैस और सोडियम सल्फेट बनता है।
हाइड्रोजन गैस के लिए परीक्षण: धातु के साथ एसिड की प्रतिक्रिया के बाद निकलने वाली गैस का परीक्षण उसके पास एक जलती हुई मोमबत्ती लाकर किया जा सकता है। यदि गैस पॉप ध्वनि के साथ बुदबुदाती है तो यह हाइड्रोजन गैस के निकलने की पुष्टि करती है। पॉप ध्वनि के साथ जलना हाइड्रोजन गैस का अभिलाक्षणिक परीक्षण है।
(ii) अम्लों की धातु कार्बोनेट के साथ अभिक्रियाः अम्ल धातु कार्बोनेट से क्रिया करके कार्बन डाइऑक्साइड गैस तथा जल के साथ संबंधित लवण देते हैं।
धातु कार्बोनेट + अम्ल → नमक + कार्बन डाइऑक्साइड + जल
उदाहरण:
हाइड्रोक्लोरिक अम्ल सोडियम कार्बोनेट से क्रिया करके कार्बन डाइऑक्साइड गैस, सोडियम क्लोराइड जल के साथ देता है।
सल्फ्यूरिक एसिड कैल्शियम कार्बोनेट के साथ अभिक्रिया करने पर कैल्शियम सल्फेट, कार्बन डाइऑक्साइड गैस, कैल्शियम सल्फेट और पानी देता है। सोडियम कार्बोनेट के साथ प्रतिक्रिया करने पर
नाइट्रिक एसिड सोडियम नाइट्रेट, पानी और कार्बन डाइऑक्साइड गैस देता है।
(iii) हाइड्रोजन कार्बोनेट (बाईकार्बोनेट) के साथ एसिड की प्रतिक्रिया: एसिड धातु हाइड्रोजन कार्बोनेट के साथ प्रतिक्रिया करने पर कार्बन डाइऑक्साइड गैस, संबंधित नमक और पानी देते हैं।
अम्ल + धातु हाइड्रोजन कार्बोनेट → लवण + कार्बन डाइऑक्साइड + जल
उदाहरण
सल्फ्यूरिक अम्ल सोडियम बाइकार्बोनेट से अभिक्रिया करके सोडियम सल्फेट, कार्बन डाइऑक्साइड गैस तथा जल देता है।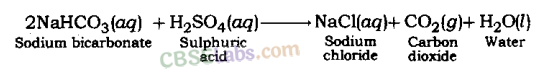
कार्बन डाइऑक्साइड गैस के विकास के लिए टेस्ट: कार्बन डाइऑक्साइड चूने के पानी को इसमें से गुजरने पर दूधिया कर देता है। यह कार्बन डाइऑक्साइड गैस के लिए अभिलाक्षणिक परीक्षण है।
धातु कार्बोनेट या धातु हाइड्रोजन कार्बोनेट के साथ एसिड की प्रतिक्रिया के कारण उत्पन्न गैस चूने के पानी को दूधिया कर देती है। इससे पता चलता है कि गैस कार्बन डाइऑक्साइड गैस है। ऐसा कैल्शियम कार्बोनेट के सफेद अवक्षेप के बनने के कारण होता है।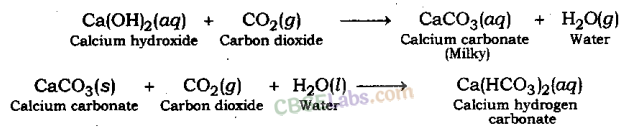
लेकिन जब चूने के पानी में कार्बन डाइऑक्साइड की अधिकता प्रवाहित की जाती है तो यह चूने के पानी का दूधिया रंग गायब कर देता है। ऐसा कैल्सियम हाइड्रोजन कार्बोनेट बनने के कारण होता है। चूंकि कैल्शियम हाइड्रोजन कार्बोनेट पानी में घुलनशील है, इसलिए विलयन मिश्रण का दूधिया रंग गायब हो जाता है।
अम्लों में सामान्यः अम्ल जब धातु से अभिक्रिया करते हैं तो हाइड्रोजन गैस देते हैं। इससे पता चलता है कि सभी अम्लों में हाइड्रोजन होती है। उदाहरण के लिए; हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल ( H2SO4 ), नाइट्रिक अम्ल (HNO3 ) , आदि । जलीय विलयन में हाइड्रोजन आयन का पृथक्करण सभी अम्लों में सामान्य गुण है। जलीय विलयन में हाइड्रोजन आयन के वियोजन के कारण अम्ल अम्लीय व्यवहार प्रदर्शित करता है। उदाहरण: हाइड्रोक्लोरिक अम्ल (HCl) जल में घुलने पर हाइड्रोजन आयन (H + ) तथा क्लोराइड आयन (Cl- ) देता है। एसिटिक अम्ल ( CH3COOH ) एसीटेट आयन देता है (CH3COO –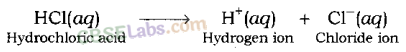
) और हाइड्रोजन आयन (एच + )।
एसिड
प्रबल अम्ल
वे अम्ल जो जल में पूर्णतः आयनित होकर (H + ) उत्पन्न करते हैं, प्रबल अम्ल कहलाते हैं। उदाहरण :
हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल ( H2SO4 ), नाइट्रिक अम्ल ( HNO3 )
कमजोर अम्ल
एक अम्ल जो पानी में आंशिक रूप से आयनित होता है और इस प्रकार थोड़ी मात्रा में हाइड्रोजन आयन (H + ) उत्पन्न करता है, दुर्बल अम्ल कहलाता है।
उदाहरण: एसिटिक एसिड (सीएच 3 सीओओएच), कार्बोनिक एसिड (एच 2 सीओ 3 )
जब अम्ल के सान्द्र विलयन को जल मिलाकर तनुकृत किया जाता है तो हाइड्रोजन आयनों (H + ) अथवा हाइड्रोनियम आयन (H3O- ) की प्रति इकाई आयतन में सान्द्रता कम हो जाती है।
क्षारः क्षार स्वाद में कड़वा होता है, स्पर्श साबुन जैसा होता है, लाल लिटमस को नीला कर देता है और जलीय विलयन में हाइड्रॉक्साइड आयन (OH-) देता है ।
उदाहरण: सोडियम हाइड्रॉक्साइड (कास्टिक सोडा) - NaOH
कैल्शियम हाइड्रॉक्साइड - Ca(OH) 2
पोटेशियम हाइड्रॉक्साइड (कास्टिक पोटाश) - (KOH)
क्षार के गुण:
- कड़वा स्वाद हो।
- छूने के लिए साबुन।
- लाल लिटमस को नीला कर देता है।
- विलयन में विद्युत का चालन करता है।
- जलीय विलयन में OH - आयन मुक्त करें
क्षारों के प्रकार: क्षारों को दो प्रकारों में विभाजित किया जा सकता है - जल घुलनशील और जल अघुलनशील।
क्षार और क्षारीय पृथ्वी धातुओं के हाइड्रॉक्साइड पानी में घुलनशील होते हैं। इन्हें क्षार के नाम से भी जाना जाता है।
उदाहरण के लिए; सोडियम हाइड्रॉक्साइड, मैग्नीशियम हाइड्रॉक्साइड, कैल्शियम हाइड्रॉक्साइड आदि। क्षार को एक मजबूत आधार माना जाता है।
क्षारों के रासायनिक गुण:
(i) धातुओं के साथ क्षार की प्रतिक्रिया: जब क्षार (क्षार) धातु के साथ प्रतिक्रिया करता है, तो यह नमक और हाइड्रोजन गैस पैदा करता है।
क्षार + धातु → नमक + हाइड्रोजन
उदाहरण: सोडियम हाइड्रॉक्साइड जिंक धातु के साथ अभिक्रिया करके हाइड्रोजन गैस और सोडियम जिंकेट देता है।
सोडियम हाइड्रोक्साइड की एल्युमिनियम धातु से अभिक्रिया करने पर सोडियम एल्युमिनेट तथा हाइड्रोजन गैस बनती है।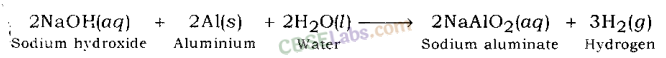
(ii) अधातुओं के ऑक्साइडों के साथ क्षार की अभिक्रियाः अधातुओं के ऑक्साइड अम्लीय प्रकृति के होते हैं। उदाहरण के लिए; कार्बन डाइऑक्साइड एक अधातु ऑक्साइड है। जब कार्बन डाइऑक्साइड को पानी में घोला जाता है तो यह कार्बोनिक एसिड पैदा करता है।
इसलिए, जब एक आधार गैर-धातु ऑक्साइड के साथ प्रतिक्रिया करता है, तो दोनों एक दूसरे को बेअसर कर देते हैं जिसके परिणामस्वरूप संबंधित नमक और पानी होता है।
क्षार + अधातु ऑक्साइड → नमक + पानी
(अधातु ऑक्साइड अम्लीय प्रकृति के होते हैं)
उदाहरण:
सोडियम हाइड्रॉक्साइड कार्बन डाइऑक्साइड के साथ अभिक्रिया करके सोडियम कार्बोनेट और पानी देता है।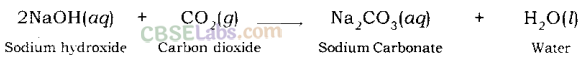
कैल्शियम हाइड्रॉक्साइड कार्बन डाइऑक्साइड के साथ अभिक्रिया करके कैल्शियम कार्बोनेट और पानी देता है।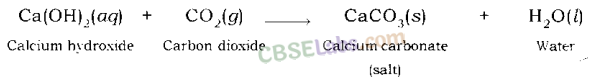
(iii) न्यूट्रलाइजेशन रिएक्शन: एक एसिड एक क्षार को बेअसर कर देता है जब वे एक दूसरे के साथ प्रतिक्रिया करते हैं और संबंधित नमक और पानी बनते हैं।
अम्ल + क्षार → लवण + जल
चूँकि अम्ल और क्षार दोनों की अभिक्रिया एक दूसरे को उदासीन कर देती है, इसलिए इसे उदासीनीकरण अभिक्रिया भी कहते हैं।
उदाहरण: सोडियम क्लोराइड और पानी तब बनता है जब हाइड्रोक्लोरिक एसिड सोडियम हाइड्रोक्साइड (एक मजबूत आधार) के साथ प्रतिक्रिया करता है।
इसी तरह, जब हाइड्रोक्लोरिक एसिड कैल्शियम हाइड्रॉक्साइड (एक आधार) के साथ प्रतिक्रिया करता है तो कैल्शियम क्लोराइड पानी के साथ बनता है।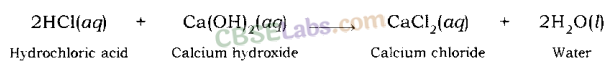
(iv) धातु ऑक्साइड के साथ अम्ल की प्रतिक्रिया: धातु ऑक्साइड क्षारीय प्रकृति के होते हैं। इस प्रकार जब कोई अम्ल किसी धातु ऑक्साइड से अभिक्रिया करता है तो दोनों एक दूसरे को उदासीन कर देते हैं। इस अभिक्रिया में संबंधित लवण तथा जल बनते हैं।
अम्ल + धातु ऑक्साइड → नमक + पानी
(धातु ऑक्साइड क्षारीय प्रकृति के होते हैं)
उदाहरण:
कैल्शियम एक धातु है, इस प्रकार, कैल्शियम ऑक्साइड एक धातु ऑक्साइड है जो प्रकृति में क्षारीय है। जब एक एसिड, जैसे हाइड्रोक्लोरिक एसिड, कैल्शियम ऑक्साइड के साथ प्रतिक्रिया करता है, तो न्यूट्रलाइजेशन रिएक्शन होता है और पानी के साथ कैल्शियम क्लोराइड बनता है।
इसी प्रकार सल्फ्यूरिक अम्ल जब जिंक ऑक्साइड से अभिक्रिया करता है तो जिंक सल्फेट तथा जल बनता है।
सभी क्षारकों में सामान्य: एक क्षार पानी में हाइड्रॉक्साइड आयन को अलग कर देता है, जो एक यौगिक के मूल व्यवहार के लिए जिम्मेदार है।
उदाहरण: जब सोडियम हाइड्रॉक्साइड को पानी में घोला जाता है, तो यह हाइड्रॉक्साइड आयन और सोडियम आयन को अलग कर देता है।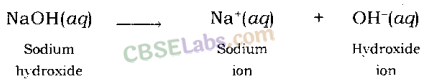
इसी प्रकार, जब पोटेशियम हाइड्रॉक्साइड को पानी में घोला जाता है, तो यह हाइड्रॉक्साइड आयन और पोटेशियम आयन को अलग कर देता है।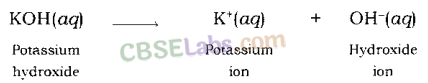
इस प्रकार, हाइड्रॉक्साइड आयन के पृथक्करण के कारण आधार अपने मूल चरित्र को दर्शाता है।
उदासीनीकरण अभिक्रिया: जब अम्ल किसी क्षार से अभिक्रिया करता है तो अम्ल का हाइड्रोजन आयन क्षार के हाइड्रॉक्साइड आयन से मिलकर जल बनाता है। चूंकि ये आयन आपस में मिलकर मुक्त रहने के बजाय पानी बनाते हैं, इस प्रकार दोनों एक दूसरे को बेअसर कर देते हैं।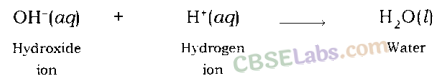
उदाहरण: जब सोडियम हाइड्रॉक्साइड (एक क्षार) हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करता है, तो सोडियम हाइड्रॉक्साइड सोडियम आयन और हाइड्रॉक्साइड आयन में टूट जाता है और हाइड्रोक्लोरिक एसिड हाइड्रोजन आयन और क्लोराइड आयन में टूट जाता है।
हाइड्रोजन आयन और हाइड्रॉक्साइड आयन एक साथ मिलकर पानी बनाते हैं, जबकि सोडियम आयन और क्लोराइड आयन एक साथ मिलकर सोडियम क्लोराइड बनाते हैं।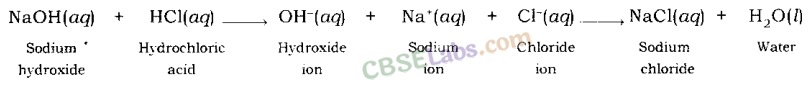
अम्ल और क्षार का तनुकरण: एक अम्ल में हाइड्रोजन आयन की सांद्रता और एक क्षार में हाइड्रॉक्साइड आयन, प्रति इकाई आयतन, अम्ल या क्षार की सांद्रता को दर्शाता है।
अम्ल को जल में मिलाने से प्रति इकाई आयतन में हाइड्रोजन आयन की सान्द्रता कम हो जाती है। इसी प्रकार जल में क्षार मिलाने पर प्रति इकाई आयतन में हाइड्रॉक्साइड आयन की सांद्रता कम हो जाती है। जल में अम्ल या क्षार मिलाने की इस प्रक्रिया को तनुकरण कहते हैं और अम्ल या क्षार को तनुकृत कहते हैं।
अम्ल या क्षार का तनुकरण ऊष्माक्षेपी होता है। इस प्रकार, अम्ल या क्षार हमेशा पानी में मिलाया जाता है और पानी कभी भी अम्ल या क्षार में नहीं डाला जाता है। यदि किसी सांद्र अम्ल या क्षार में पानी डाला जाता है, तो बहुत अधिक गर्मी उत्पन्न होती है, जिससे अम्ल या क्षार के छींटे पड़ सकते हैं और गंभीर नुकसान हो सकता है क्योंकि केंद्रित अम्ल और क्षार अत्यधिक संक्षारक होते हैं।
अम्ल एवं क्षार की प्रबलता (Strong of acid and base) : वे अम्ल जिनमें हाइड्रोजन आयन का पूर्ण पृथक्करण होता है, प्रबल अम्ल कहलाते हैं। इसी प्रकार जिन क्षारों में हाइड्रॉक्साइड आयन का पूर्ण पृथक्करण होता है, उन्हें प्रबल क्षार कहते हैं।
खनिज अम्ल जैसे हाइड्रोक्लोरिक अम्ल, सल्फ्यूरिक अम्ल, नाइट्रिक अम्ल आदि में हाइड्रोजन आयन पूर्णतः वियोजित हो जाते हैं अतः इन्हें प्रबल अम्ल माना जाता है। चूंकि अकार्बनिक एसिड हाइड्रोजन आयन पूरी तरह से अलग नहीं होते हैं, इसलिए वे कमजोर एसिड होते हैं।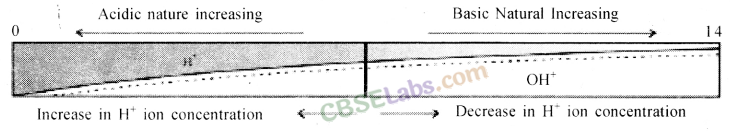
पानी या तटस्थ समाधान के लिए: पीएच = 7
अम्लीय समाधान के लिए: पीएच <7
बुनियादी समाधान के लिए: पीएच> 7
यूनिवर्सल इंडिकेटर: लिटमस पेपर, फिनोलफथेलिन, मिथाइल ऑरेंज आदि का उपयोग करके किसी घोल का केवल अम्लीय या क्षारीय चरित्र निर्धारित किया जा सकता है, लेकिन इन संकेतकों के उपयोग से अम्ल या क्षार की ताकत का अंदाजा नहीं होता है। अत: किसी दिए गए विलयन की सामर्थ्य के साथ-साथ अम्लीय तथा क्षारकीय प्रकृति प्राप्त करने के लिए सार्वत्रिक सूचक का प्रयोग किया जाता है।
यूनिवर्सल इंडिकेटर किसी दिए गए समाधान के लिए 1 से 14 तक पीएच मान की सीमा पर अलग-अलग रंग दिखाता है। यूनिवर्सल इंडिकेटर स्ट्रिप्स और समाधान दोनों के रूप में उपलब्ध है। यूनिवर्सल इंडिकेटर कई संकेतकों का संयोजन है, जैसे कि पानी, प्रोपेनोल, फिनोलफथेलिन, सोडियम नमक, सोडियम हाइड्रॉक्साइड, मिथाइल रेड, ब्रोमोथाइमोल ब्लू मोनोसोडियम नमक और थाइमोल ब्लू मोनोसोडियम नमक। रंग मिलान चार्ट एक सार्वभौमिक संकेतक के साथ प्रदान किया जाता है जो पीएच के विभिन्न मूल्यों के लिए अलग-अलग रंग दिखाता है।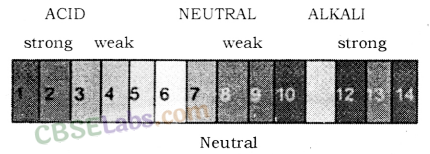
विभिन्न रंगों द्वारा दिखाया गया पीएच मान दैनिक जीवन में पीएच की भूमिका:
(i) हमारे पाचन तंत्र में पीएच: तनु एचसीएल (हाइड्रोक्लोरिक एसिड) हमारे पेट में भोजन (प्रोटीन) के पाचन में मदद करता है। पेट में अतिरिक्त अम्ल अम्लता (अपच) का कारण बनता है। मैग्नीशियम हाइड्रॉक्साइड [Mg(OH) 2 ] जैसे एंटासिड्स को मैग्नेशिया के दूध के रूप में भी जाना जाता है और सोडियम हाइड्रोजन कार्बोनेट (बेकिंग सोडा) का उपयोग अतिरिक्त एसिड को बेअसर करने के लिए किया जाता है।
(ii) अम्ल के कारण होने वाला दंत क्षय: हमारे मुंह में उपस्थित जीवाणु शर्करा को अम्ल में परिवर्तित कर देते हैं। जब मुँह में बनने वाले अम्ल का pH 5.5 से कम हो जाता है तो दाँतों का सड़ना शुरू हो जाता है। अच्छी गुणवत्ता वाले टूथपेस्ट से दांतों को साफ करके अतिरिक्त एसिड को हटाना होता है क्योंकि इस प्रकार के टूथपेस्ट प्रकृति में क्षारीय होते हैं।
(iii) पीएच और पौधों की वृद्धि की मिट्टी: जब मिट्टी में एक विशिष्ट पीएच (7 के करीब) रेंज होती है, जो न तो क्षारीय होती है और न ही अत्यधिक अम्लीय होती है, तो अधिकांश पौधों की स्वस्थ वृद्धि होती है। इसलिए,
- यौगिक 'X' सोडियम हाइड्रोक्साइड (NaOH) है।
- यौगिक 'ए' जिंक सल्फेट (ZnSO4 ) है।
- यौगिक 'B' सोडियम क्लोराइड (NaCl) है।
- यौगिक 'C' सोडियम एसीटेट ( CH3 COONa ) है।
लवण: लवण आयनिक यौगिक होते हैं जो अम्ल और क्षार के बीच उदासीनीकरण प्रतिक्रिया के बाद उत्पन्न होते हैं। लवण विद्युत रूप से उदासीन होते हैं। बहुत सारे लवण हैं लेकिन उनमें से सोडियम क्लोराइड सबसे आम है। सोडियम क्लोराइड को टेबल नमक या सामान्य नमक के रूप में भी जाना जाता है। सोडियम क्लोराइड का इस्तेमाल खाने का स्वाद बढ़ाने के लिए किया जाता है।
नमक के गुण:
- अधिकांश लवण क्रिस्टलीय मृदा हैं।
- लवण पारदर्शी या अपारदर्शी हो सकते हैं।
- अधिकांश लवण जल में घुलनशील होते हैं।
- लवणों का विलयन गलित अवस्था में भी विद्युत का चालन करता है।
- नमक नमकीन, खट्टा, मीठा, कड़वा और उमामी (स्वादिष्ट) हो सकता है।
- उदासीन लवण गंधहीन होते हैं।
- लवण रंगहीन या रंगीन हो सकते हैं।
नमक का परिवार: सामान्य अम्लीय या मूल मूलक वाले लवण एक ही परिवार के होते हैं।
उदाहरण: ( i
) सोडियम क्लोराइड (NaCl) और कैल्शियम क्लोराइड (CaCl2 ) क्लोराइड परिवार से संबंधित हैं। (ii) कैल्शियम क्लोराइड (CaCl2 ) और कैल्शियम सल्फेट (CaSO4 ) कैल्शियम परिवार से संबंधित हैं। (iii) जिंक क्लोराइड (ZnCl2 ) और जिंक सल्फेट ( ZnSO4 ) जिंक परिवार के हैं।
तटस्थ, अम्लीय और मूल लवण:
(i) तटस्थ नमक: एक मजबूत एसिड और मजबूत आधार के बीच प्रतिक्रिया के कारण उत्पन्न लवण प्रकृति में तटस्थ होते हैं। ऐसे लवणों का पीएच मान 7 के बराबर होता है, अर्थात तटस्थ।
उदाहरण : सोडियम क्लोराइड, सोडियम सल्फेट। पोस्टैशियम क्लोराइड, आदि।
सोडियम क्लोराइड (NaCl): यह हाइड्रोक्लोरिक एसिड (एक मजबूत एसिड) और सोडियम हाइड्रोक्साइड (एक मजबूत आधार) के बीच प्रतिक्रिया के बाद बनता है।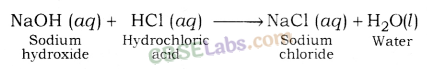
सोडियम सल्फेट (Na2SO4 ) : यह सोडियम हाइड्रोक्साइड (एक मजबूत आधार) और सल्फ्यूरिक एसिड (एक मजबूत एसिड) के बीच प्रतिक्रिया के बाद बनता है।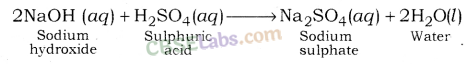
पोटेशियम क्लोराइड (KCl): यह पोटेशियम हाइड्रोक्साइड (एक मजबूत आधार) और हाइड्रोक्लोरिक एसिड (एक मजबूत एसिड) के बीच प्रतिक्रिया के बाद बनता है।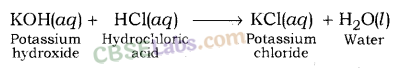
(ii) अम्लीय लवण : प्रबल अम्ल और दुर्बल क्षार की अभिक्रिया से बनने वाले लवण अम्लीय लवण कहलाते हैं। अम्लीय नमक का पीएच मान 7 से कम होता है। उदाहरण के लिए अमोनियम सल्फेट, अमोनियम क्लोराइड आदि।
हाइड्रोक्लोरिक एसिड (एक मजबूत एसिड) और अमोनियम हाइड्रॉक्साइड (एक कमजोर आधार) के बीच प्रतिक्रिया के बाद अमोनियम क्लोराइड बनता है।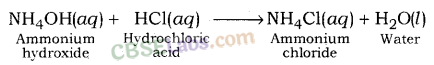
अमोनियम हाइड्रॉक्साइड (एक कमजोर आधार) और सल्फ्यूरिक एसिड (एक मजबूत एसिड) के बीच प्रतिक्रिया के बाद अमोनियम सल्फेट बनता है।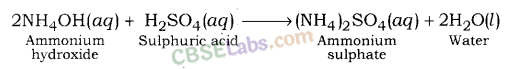
(iii) क्षारीय लवण : दुर्बल अम्ल तथा प्रबल क्षार की अभिक्रिया से बनने वाले लवण क्षारीय लवण कहलाते हैं। उदाहरण के लिए; सोडियम कार्बोनेट, सोडियम एसीटेट, आदि।
सोडियम हाइड्रोक्साइड (एक मजबूत आधार) और कार्बोनिक एसिड (एक कमजोर एसिड) के बीच प्रतिक्रिया के बाद सोडियम कार्बोनेट बनता है।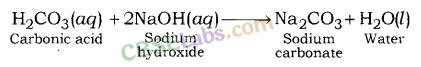
सोडियम एसीटेट एक मजबूत आधार, सोडियम हाइड्रोक्साइड (एक मजबूत आधार) और एसिटिक एसिड, (एक कमजोर एसिड) के बीच प्रतिक्रिया के बाद बनता है।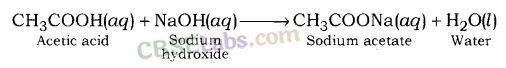
अम्लीय, क्षारकीय तथा उदासीन लवणों के बनने के कारण:
- जब एक मजबूत अम्ल कमजोर क्षार के साथ प्रतिक्रिया करता है, तो क्षार अम्ल को पूरी तरह से बेअसर करने में असमर्थ होता है। इसके कारण एक अम्लीय लवण बनता है।
- जब एक मजबूत आधार कमजोर एसिड के साथ प्रतिक्रिया करता है, तो एसिड बेस को पूरी तरह से बेअसर करने में असमर्थ होता है। इसके कारण एक क्षारीय लवण बनता है।
- जब समान रूप से मजबूत एसिड और बेस प्रतिक्रिया करते हैं, तो वे एक दूसरे को पूरी तरह से बेअसर कर देते हैं। इसके कारण उदासीन लवण बनता है।
नमक का पीएच मान:
- तटस्थ नमक: एक तटस्थ नमक का पीएच मान लगभग 7 के बराबर होता है।
- अम्लीय लवण: अम्लीय लवण का pH मान 7 से कम होता है।
- क्षारीय नमक: एक क्षारीय नमक का पीएच मान 7 से अधिक होता है।
कुछ महत्वपूर्ण रासायनिक यौगिक
1. साधारण नमक (सोडियम क्लोराइड): सोडियम क्लोराइड (NaCl) को साधारण या खाने का नमक भी कहा जाता है। यह सोडियम हाइड्रोक्साइड और हाइड्रोक्लोरिक एसिड के बीच प्रतिक्रिया के बाद बनता है। यह एक तटस्थ नमक है। सोडियम क्लोराइड का पीएच मान लगभग 7 होता है। सोडियम क्लोराइड का इस्तेमाल खाने का स्वाद बढ़ाने के लिए किया जाता है। सोडियम क्लोराइड का उपयोग कई रसायनों के निर्माण में किया जाता है।
सोडियम क्लोराइड से महत्वपूर्ण रसायन
सोडियम हाइड्रोक्साइड (NaOH): सोडियम हाइड्रोक्साइड एक प्रबल क्षार है। इसे कास्टिक सोडा के नाम से भी जाना जाता है। यह सोडियम क्लोराइड (नमकीन) के घोल के इलेक्ट्रोलाइटिक अपघटन द्वारा प्राप्त किया जाता है। नमकीन (सोडियम क्लोराइड का जलीय घोल) के इलेक्ट्रोलाइटिक अपघटन की प्रक्रिया में, नमकीन सोडियम हाइड्रॉक्साइड बनाने के लिए विघटित हो जाता है। इस प्रक्रिया में ऐनोड पर क्लोरीन तथा कैथोड पर उप-उत्पादों के रूप में हाइड्रोजन गैस प्राप्त होती है। इस पूरी प्रक्रिया को क्लोर-क्षार प्रक्रिया के रूप में जाना जाता है।
ब्राइन के इलेक्ट्रोलिसिस के बाद उत्पादों का उपयोग:
- हाइड्रोजन गैस का उपयोग ईंधन, मार्जरीन, उर्वरक आदि के लिए अमोनिया बनाने में किया जाता है।
- क्लोरीन गैस का उपयोग जल उपचार, पीवीसी के निर्माण, कीटाणुनाशक, सीएफसी, कीटनाशकों में किया जाता है। इसका उपयोग ब्लीचिंग पाउडर और हाइड्रोक्लोरिक एसिड के निर्माण में भी किया जाता है।
- सोडियम हाइड्रॉक्साइड का उपयोग धातुओं को कम करने, कागज, साबुन, डिटर्जेंट, कृत्रिम फाइबर, ब्लीच आदि के निर्माण के लिए किया जाता है।
2. विरंजक चूर्ण (CaOCl2 ) : विरंजक चूर्ण को चूने का क्लोराइड भी कहा जाता है। यह एक ठोस और पीले सफेद रंग का होता है। ब्लीचिंग पाउडर को क्लोरीन की तेज गंध से आसानी से पहचाना जा सकता है।
जब कैल्सियम हाइड्रॉक्साइड (बुझा हुआ चूना) क्लोरीन से अभिक्रिया करता है तो यह कैल्सियम ऑक्सीक्लोराइड (विरंजक चूर्ण) देता है और जल बनता है।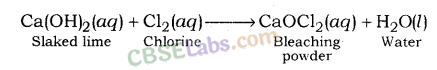
विरंजक चूर्ण का जलीय विलयन क्षारीय प्रकृति का होता है। ब्लीच शब्द का अर्थ है रंग हटाना। विरंजक चूर्ण का प्रयोग प्राय: विरंजक के रूप में किया जाता है। यह ऑक्सीकरण के कारण काम करता है। ब्लीचिंग पाउडर में मौजूद क्लोरीन ब्लीचिंग इफेक्ट के लिए जिम्मेदार होता है।
ब्लीचिंग पाउडर का उपयोग:
- ब्लीचिंग पाउडर का उपयोग पानी को साफ करने के लिए कीटाणुनाशक, मॉस रिमूवर, खरपतवार नाशक आदि के रूप में किया जाता है।
- विरंजक चूर्ण का उपयोग कपड़ा उद्योग में कपास के विरंजन के लिए, कागज उद्योग में लकड़ी की लुगदी के विरंजन के लिए किया जाता है।
- ब्लीचिंग पाउडर का उपयोग कई उद्योगों में ऑक्सीकरण एजेंट के रूप में किया जाता है, जैसे कपड़ा उद्योग, कागज उद्योग आदि।
3. बेकिंग सोडा (NaHCO 3 ): बेकिंग सोडा एक अन्य महत्वपूर्ण उत्पाद है जिसे क्लोर-क्षार प्रक्रिया के उप-उत्पादों का उपयोग करके प्राप्त किया जा सकता है। बेकिंग सोडा का रासायनिक नाम सोडियम हाइड्रोजन कार्बोनेट (NaHCO3 ) या सोडियम बाइकार्बोनेट है। ब्रेड सोडा, कुकिंग सोडा, बाइकार्बोनेट ऑफ़ सोडा, सोडियम बाइकार्ब, सोडा ऑफ़ बाइकार्ब या बस बाइकार्ब, आदि बेकिंग सोडा के कुछ अन्य नाम हैं।
बनाने की विधि: बेकिंग सोडा ब्राइन की कार्बन डाइऑक्साइड और अमोनिया के साथ अभिक्रिया से प्राप्त होता है। इसे सोल्वे प्रक्रिया के रूप में जाना जाता है।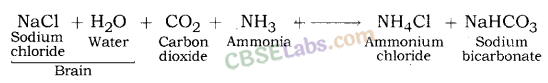
इस प्रक्रिया में, कैल्शियम कार्बोनेट का उपयोग CO2 के स्रोत के रूप में किया जाता है और परिणामी कैल्शियम ऑक्साइड का उपयोग अमोनियम क्लोराइड से अमोनिया को पुनर्प्राप्त करने के लिए किया जाता है।
सोडियम बाइकार्बोनेट के गुण:
- सोडियम बाइकार्बोनेट सफेद क्रिस्टलीय ठोस होता है, लेकिन यह महीन पाउडर के रूप में दिखाई देता है।
- सोडियम हाइड्रोजन कार्बोनेट उभयधर्मी प्रकृति का होता है।
- सोडियम हाइड्रोजन कार्बोनेट पानी में विरल रूप से घुलनशील है।
- सोडियम हाइड्रोजन कार्बोनेट (बेकिंग सोडा) का ऊष्मीय अपघटन।
- जब बेकिंग सोडा को गर्म किया जाता है, तो यह सोडियम कार्बोनेट, कार्बन डाइऑक्साइड और पानी में विघटित हो जाता है।
2NaHCO 3 + गर्मी → ना 2 सीओ 3 + सीओ 2 + एच 2 ओ - सोडियम हाइड्रोजन कार्बोनेट के थर्मल अपघटन के बाद बनने वाला सोडियम कार्बोनेट आगे गर्म करने पर सोडियम ऑक्साइड और कार्बन डाइऑक्साइड में विघटित हो जाता है।
Na 2 CO 3 → Na 2 O + CO 2
इस प्रतिक्रिया को निर्जलीकरण प्रतिक्रिया के रूप में जाना जाता है।
बेकिंग सोडा का उपयोग:
- बेकिंग सोडा का उपयोग बेकिंग पाउडर बनाने में किया जाता है, जिसका उपयोग खाना पकाने में किया जाता है क्योंकि यह कार्बन डाइऑक्साइड पैदा करता है जो बैटर को नरम और स्पंजी बनाता है।
- बेकिंग सोडा का उपयोग एंटासिड के रूप में किया जाता है।
- टूथपेस्ट में बेकिंग सोडा का इस्तेमाल किया जाता है जो दांतों को सफेद और प्लाक फ्री बनाता है।
- बेकिंग सोडा का उपयोग चाँदी के गहनों की सफाई में किया जाता है।
- चूँकि सोडियम हाइड्रोजन कार्बोनेट प्रबल ताप पर कार्बन डाइऑक्साइड और सोडियम ऑक्साइड देता है, इसलिए इसका उपयोग अग्निशामक के रूप में किया जाता है।
बेकिंग पाउडर: बेकिंग पाउडर गर्म करने पर कार्बन डाइऑक्साइड पैदा करता है, इसलिए इसका उपयोग बैटर को स्पंजी बनाने के लिए पकाने में किया जाता है। वैसे तो बेकिंग सोडा गर्म करने पर कार्बन डाइऑक्साइड भी पैदा करता है, लेकिन इसका उपयोग खाना पकाने में नहीं किया जाता क्योंकि बेकिंग सोडा गर्म करने पर कार्बन डाइऑक्साइड के साथ सोडियम कार्बोनेट पैदा करता है। इस प्रकार उत्पादित सोडियम कार्बोनेट स्वाद को कड़वा बना देता है।
बेकिंग पाउडर बेकिंग सोडा और एक हल्के खाद्य अम्ल का मिश्रण है। आमतौर पर बेकिंग पाउडर बनाने के लिए बेकिंग सोडा में टार्टरिक एसिड मिलाया जाता है।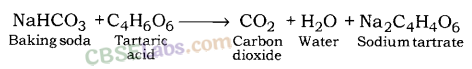
जब बेकिंग पाउडर को गर्म किया जाता है, तो सोडियम हाइड्रोजन कार्बोनेट (NaHCO3 ) विघटित होकर CO2 और सोडियम कार्बोनेट (Na2CO3 ) देता है । सीओ 2 ब्रेड और केक को फूला हुआ बनाता है। टार्टरिक अम्ल Na2CO3 बनने के कारण कड़वे स्वाद को दूर करने में मदद करता है ।
4. वाशिंग सोडा (सोडियम कार्बोनेट)
बनाने की विधि: सोडियम कार्बोनेट का निर्माण सॉल्वे प्रक्रिया द्वारा प्राप्त सोडियम हाइड्रोजन कार्बोनेट के ताप अपघटन द्वारा किया जाता है।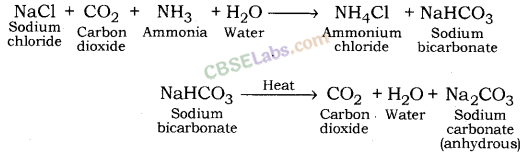
इस प्रक्रिया में प्राप्त सोडियम कार्बोनेट शुष्क होता है। इसे सोडा ऐश या निर्जल सोडियम कार्बोनेट कहते हैं। धोने का सोडा निर्जल सोडियम कार्बोनेट के पुनर्जलीकरण द्वारा प्राप्त किया जाता है।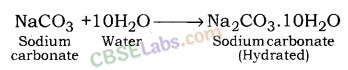
चूंकि वाशिंग सोडा में पानी के 10 अणु होते हैं, इसलिए इसे सोडियम बाइकार्बोनेट डेकाहाइड्रेट कहा जाता है।
सोडियम कार्बोनेट एक क्रिस्टलीय ठोस है और यह पानी में घुलनशील होता है जब अधिकांश कार्बोनेट पानी में अघुलनशील होते हैं।
सोडियम कार्बोनेट का उपयोग:
- विशेषकर ग्रामीण क्षेत्रों में इसका उपयोग कपड़ों की सफाई में किया जाता है।
- डिटर्जेंट केक और पाउडर बनाने में।
- जल की स्थायी कठोरता को दूर करने में।
- इसका उपयोग कांच और कागज उद्योगों में किया जाता है।
क्रिस्टलीकरण का पानी: कई लवणों में पानी के अणु होते हैं और इन्हें हाइड्रेटेड साल्ट के रूप में जाना जाता है। नमक में मौजूद पानी के अणु को क्रिस्टलीकरण के पानी के रूप में जाना जाता है।
उदाहरण:
कॉपर सल्फेट पेंटाहाइड्रेट (CuSO4 .5H2O ) : कॉपर सल्फेट का नीला रंग पानी के 5 अणुओं की उपस्थिति के कारण होता है। जब कॉपर सल्फेट को गर्म किया जाता है, तो यह पानी के अणुओं को खो देता है और ग्रे-सफेद रंग में बदल जाता है, जिसे निर्जल कॉपर सल्फेट के रूप में जाना जाता है। जल मिलाने पर निर्जल कॉपर सल्फेट पुनः नीला हो जाता है।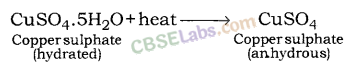
अम्ल: वे पदार्थ जो नीले लिटमस विलयन को लाल कर देते हैं, अम्ल कहलाते हैं। अम्ल स्वाद में खट्टे होते हैं।
क्षार: वे पदार्थ जो लाल लिटमस विलयन को नीला कर देते हैं क्षारक कहलाते हैं। ये स्वाद में कड़वे होते हैं।
खनिज अम्ल: वे अम्ल जो सल्फेट, नाइट्रेट, क्लोराइड आदि खनिजों से प्राप्त होते हैं, खनिज अम्ल कहलाते हैं, उदाहरण के लिए, H2SO4 ( सल्फ्यूरिक अम्ल), HNO3 ( नाइट्रिक अम्ल) और HCl (हाइड्रोक्लोरिक अम्ल)।
कार्बनिक अम्ल: वे अम्ल जो पौधों और जंतुओं से प्राप्त होते हैं, कार्बनिक अम्ल कहलाते हैं। उदाहरण साइट्रिक एसिड, एस्कॉर्बिक एसिड, टार्टरिक एसिड, लैक्टिक एसिड, एसिटिक एसिड।
हाइड्रोनियम आयन: ये H + (एसिड से) और H2O की प्रतिक्रिया से बनते हैं । ऐसा इसलिए है क्योंकि H + अस्थिर है।
यूनिवर्सल इंडिकेटर: एक यूनिवर्सल इंडिकेटर संकेतकों का एक मिश्रण है जो एच + आयनों की एकाग्रता में परिवर्तन की एक बहुत विस्तृत श्रृंखला में रंग परिवर्तन की एक क्रमिक लेकिन अच्छी तरह से चिह्नित श्रृंखला दिखाता है ।
प्रबल अम्ल: वे अम्ल जो आयनों में पूर्णतः वियोजित हो जाते हैं प्रबल अम्ल कहलाते हैं। उदाहरण, एच 2 एसओ 4 , एचसीएल।
दुर्बल अम्ल: जो अम्ल पूर्णतः आयनों में वियोजित नहीं होते, दुर्बल अम्ल कहलाते हैं। उदाहरण, साइट्रिक एसिड, एसिटिक एसिड।
अम्ल के रासायनिक गुण:
- अम्ल सक्रिय धातुओं से अभिक्रिया करके लवण तथा हाइड्रोजन गैस बनाते हैं।
- अम्ल धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट से अभिक्रिया कर लवण, जल और कार्बन डाइऑक्साइड देते हैं।
- अम्ल क्षारों से अभिक्रिया कर लवण तथा जल देते हैं। इस अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं।
- अम्ल धातु के आक्साइड से अभिक्रिया कर लवण तथा जल देते हैं।
क्षारों के रासायनिक गुण:
- धातुओं के साथ अभिक्रिया: कुछ धातुएँ जैसे जस्ता, एल्युमिनियम और टिन गर्म करने पर क्षार विलयनों के साथ अभिक्रिया करती हैं और हाइड्रोजन गैस निकलती है।
- एसिड के साथ प्रतिक्रिया: नमक और पानी बनाने के लिए क्षार एसिड के साथ प्रतिक्रिया करते हैं।
संकेतक: संकेतक वे पदार्थ होते हैं जो अपने रंग परिवर्तन द्वारा विलयन की अम्लीय या क्षारीय प्रकृति का संकेत देते हैं।
पीएच स्केल : एक समाधान में हाइड्रोजन आयन एकाग्रता को मापने के लिए एक पैमाना।
किसी विलयन के pH को मोल प्रति लीटर में हाइड्रोजन आयन सांद्रता के ऋणात्मक लघुगणक के रूप में परिभाषित किया जाता है।
पीएच = -लॉग [एच + ]
पीएच = -लॉग [एच 3 ओ + ]
जहां [एच + ] या [एच 3 ओ + ] एक समाधान में हाइड्रोजन आयनों की सांद्रता का प्रतिनिधित्व करता है।
- उदासीन विलयन का pH 7 होता है।
- अम्लीय विलयन का pH <7 होता है।
- एक क्षारीय विलयन का pH > 7 होता है।
कुछ महत्वपूर्ण यौगिक एवं उनके उपयोग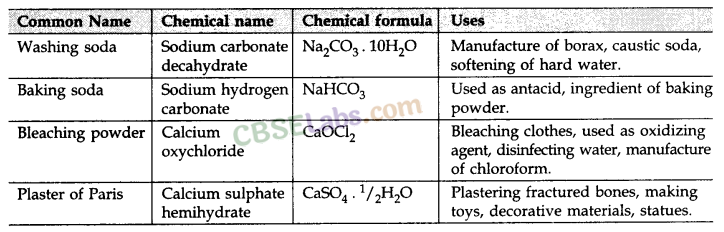
अम्ल, क्षार और लवण के समीकरण:
- अम्ल + धातु → नमक + हाइड्रोजन गैस
H 2SO 4 + Zn → ZnSO 4 + H 2 - आधार + धातु → नमक + हाइड्रोजन गैस
2NaOH + Zn → Na 2 ZnO 2 (सोडियम जिंकेट) + H 2 - क्षार + अम्ल → नमक + पानी
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O ( l) - अम्ल पानी में हाइड्रोनियम आयन देते हैं
HCl + H2O → H3O + + Cl – - क्षार पानी में OH- आयन उत्पन्न करते हैं
NaOH (aq) + H 2 O → Na + (aq) + O - (aq)
महत्वपूर्ण रासायनिक यौगिकों की प्रतिक्रियाएँ:
- विरंजक चूर्ण तैयार करना: बुझे बुझे चूने पर क्लोरीन की क्रिया द्वारा
Ca(OH) 2 + Cl2 → CaOCl2 + H2O - बेकिंग सोडा गर्म करने पर CO2 मुक्त करता है
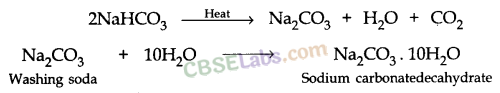
- प्लास्टर ऑफ पेरिस की तैयारी:
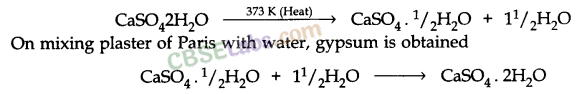





0 Comments