रासायनिक प्रतिक्रियाएँ और समीकरण: संतुलित और असंतुलित रासायनिक समीकरण और रासायनिक समीकरणों का संतुलन।
रासायनिक प्रतिक्रिया कक्षा 10 क्या है?
रासायनिक अभिक्रिया: रासायनिक पदार्थ का दूसरे रासायनिक पदार्थ में परिवर्तन को रासायनिक अभिक्रिया कहते हैं। उदाहरण: लोहे में जंग लगना, दूध का दही में जमना, भोजन का पाचन, श्वसन आदि।
रासायनिक अभिक्रिया में एक नया पदार्थ बनता है जो मूल पदार्थ से गुणों में पूर्णतः भिन्न होता है इसलिए रासायनिक अभिक्रिया में रासायनिक परिवर्तन होता है।
रासायनिक अभिक्रिया में केवल परमाणुओं की पुनर्व्यवस्था होती है।
- रासायनिक अभिक्रिया में भाग लेने वाले पदार्थ अभिकारक कहलाते हैं।
- रासायनिक अभिक्रिया के परिणामस्वरूप उत्पन्न होने वाले नए पदार्थ उत्पाद कहलाते हैं।
उदाहरण: मैग्नीशियम का हवा में जलना मैग्नीशियम ऑक्साइड बनाना एक रासायनिक प्रतिक्रिया का एक उदाहरण है।
2 एमजी (एस) + ओ 2 (जी)
हवा में जलाने से पहले मैग्नीशियम रिबन को रेगमाल से रगड़ कर साफ किया जाता है।
यह मैग्नीशियम रिबन की सतह से बुनियादी मैग्नीशियम कार्बोनेट की सुरक्षात्मक परत को हटाने के लिए किया जाता है।
अभिकारक : रासायनिक अभिक्रिया में भाग लेने वाले पदार्थ अभिकारक कहलाते हैं।
उदाहरण: एमजी और ओ 2 ।
उत्पाद: रासायनिक अभिक्रिया के बाद बनने वाले नए पदार्थ को उत्पाद कहते हैं।
उदाहरण: एमजीओ।
रासायनिक अभिक्रियाओं के अभिलक्षण
(i) गैस का विकास: जस्ता और तनु सल्फ्यूरिक एसिड के बीच रासायनिक प्रतिक्रिया हाइड्रोजन गैस के विकास की विशेषता है।
Zn(s) + H2SO4 ( aq ) → ZnSO4 ( aq) + H2 (g) ↑
(ii) रंग में परिवर्तन: साइट्रिक एसिड और बैंगनी रंग के पोटेशियम परमैंगनेट के घोल के बीच रासायनिक प्रतिक्रिया को बैंगनी से रंगहीन रंग में परिवर्तन की विशेषता है।
सल्फर डाइऑक्साइड गैस और अम्लीकृत पोटेशियम डाइक्रोमेट घोल के बीच रासायनिक प्रतिक्रिया नारंगी से हरे रंग में रंग में परिवर्तन की विशेषता है।
(iii) पदार्थ की अवस्था में परिवर्तन: मोमबत्ती मोम की दहन प्रतिक्रिया को ठोस से तरल और गैस में अवस्था में परिवर्तन की विशेषता है (क्योंकि मोम एक ठोस है, मोम के दहन से बना पानी कमरे के तापमान पर तरल होता है जबकि , मोम के दहन से उत्पन्न कार्बन डाइऑक्साइड एक गैस है)। कुछ रासायनिक अभिक्रियाएँ ऐसी होती हैं जो एक से अधिक अभिलक्षण प्रदर्शित कर सकती हैं।
(iv) तापमान में परिवर्तन: बिना बुझे चूने के पानी से बुझा हुआ चूना बनाने की रासायनिक अभिक्रिया तापमान में परिवर्तन (जो तापमान में वृद्धि है) की विशेषता है।
जिंक ग्रेन्यूल्स और तनु सल्फ्यूरिक एसिड के बीच रासायनिक प्रतिक्रिया भी तापमान में बदलाव (जो तापमान में वृद्धि है) की विशेषता है।
(v) अवक्षेप का बनना सल्फ्यूरिक अम्ल और बेरियम क्लोराइड विलयन के बीच रासायनिक अभिक्रिया की विशेषता बेरियम सल्फेट के सफेद अवक्षेप का बनना है।
BaCl 2 (aq) + H 2 SO 4 (aq) → BaSO 4 (s) (ppt) + 2HCl (aq)
कक्षा 10 का रासायनिक समीकरण क्या है?
रासायनिक समीकरण (Chemical Equation) रासायनिक अभिक्रिया को पदार्थों के प्रतीकों और सूत्रों द्वारा निरूपित करने को रासायनिक समीकरण कहते हैं।
उदाहरण: A + B → C + D
इस समीकरण में, A और B को अभिकारक कहा जाता है और C और D को उत्पाद कहा जाता है। तीर रासायनिक प्रतिक्रिया की दिशा दिखाता है। स्थिति, यदि कोई हो, सामान्यतः तीर के ऊपर लिखी जाती है।
हाइड्रोजन जब ऑक्सीजन से अभिक्रिया करती है तो जल देती है। इस अभिक्रिया को निम्नलिखित रासायनिक समीकरण द्वारा दर्शाया जा सकता है: हाइड्रोजन
+ ऑक्सीजन → जल H2 + O2 →
H2O पहले समीकरण में शब्दों का प्रयोग किया गया है और दूसरे में रासायनिक समीकरण लिखने के लिए पदार्थों के प्रतीक का प्रयोग किया गया है। सुविधा के लिए पदार्थ के प्रतीक का प्रयोग रासायनिक समीकरणों को दर्शाने के लिए किया जाता है। एक रासायनिक समीकरण संक्षिप्त और सूचनात्मक तरीके से रासायनिक प्रतिक्रिया का प्रतिनिधित्व करने का एक तरीका है। एक रासायनिक समीकरण को दो प्रकारों में विभाजित किया जा सकता है: संतुलित रासायनिक समीकरण और असंतुलित रासायनिक समीकरण।
(ए) संतुलित रासायनिक समीकरण: एक संतुलित रासायनिक समीकरण में प्रत्येक तत्व के परमाणुओं की संख्या दोनों तरफ बराबर होती है।
उदाहरण: Zn + H 2 SO 4 → ZnSO 4 + H 2
इस समीकरण में दोनों तरफ जिंक, हाइड्रोजन और सल्फेट की संख्या बराबर है, इसलिए यह एक संतुलित रासायनिक समीकरण है।
द्रव्यमान के संरक्षण के नियम के अनुसार, रासायनिक अभिक्रिया में द्रव्यमान को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है। इस नियम का पालन करने के लिए, अभिकारकों में मौजूद तत्वों का कुल द्रव्यमान उत्पादों में मौजूद तत्वों के कुल द्रव्यमान के बराबर होना चाहिए।
(b) असंतुलित रासायनिक समीकरण: यदि अभिकारकों में प्रत्येक तत्व के परमाणुओं की संख्या उत्पाद में मौजूद प्रत्येक तत्व के परमाणुओं की संख्या के बराबर नहीं होती है, तो रासायनिक समीकरण को असंतुलित रासायनिक समीकरण कहा जाता है।
उदाहरण: Fe + H 2 O → Fe 3 O 4 + H 2
इस उदाहरण में, प्रतिक्रिया के दो पक्षों में तत्वों के परमाणुओं की संख्या बराबर नहीं है। उदाहरण के लिए; बाईं ओर केवल एक लोहे का परमाणु मौजूद है, जबकि तीन लोहे के परमाणु दाईं ओर मौजूद हैं। अतः यह एक असंतुलित रासायनिक समीकरण है।
रासायनिक समीकरण को संतुलित करना: दिए गए या किसी भी रासायनिक समीकरण को संतुलित करने के लिए, इन चरणों का पालन करें:
Fe + H 2 O → Fe 3 O 4 + H 2
अभिकारकों और उत्पादों में मौजूद तत्वों के परमाणुओं की संख्या को एक तालिका में लिखें जैसा कि यहाँ दिखाया गया है .
| परमाणु का नाम | अभिकारक में परमाणुओं की संख्या | उत्पाद में परमाणुओं की संख्या |
| लोहा | 1 | 3 |
| हाइड्रोजन | 2 | 2 |
| ऑक्सीजन | 1 | 4 |
रासायनिक समीकरण के दोनों ओर संख्या में अधिकतम परमाणु को संतुलित करें।
इस समीकरण में दाएँ पक्ष पर ऑक्सीजन परमाणु की संख्या अधिकतम होती है।
ऑक्सीजन को संतुलित करने के लिए, एलएचएस पर ऑक्सीजन को 4 से गुणा करने की आवश्यकता होती है, ताकि दोनों तरफ ऑक्सीजन परमाणुओं की संख्या बराबर हो जाए।
Fe + 4 × H 2 O → Fe 3 O 4 + H 2
अब LHS पर हाइड्रोजन परमाणुओं की संख्या 8 हो जाती है, जो RHS से अधिक है। इसे संतुलित करने के लिए, आरएचएस पर हाइड्रोजन को 4 से गुणा करना होगा।
Fe + 4 × H 2 O → Fe 3 O 4 + 4 × H 2
इसके बाद दोनों तरफ ऑक्सीजन और हाइड्रोजन के परमाणुओं की संख्या बराबर हो जाती है। बाईं ओर लोहे की संख्या एक है, जबकि दाईं ओर तीन है। इसे संतुलित करने के लिए, एलएचएस पर लोहे को 3 से गुणा करें।
3 × Fe + 4 × H 2 O → Fe 3 O 4 + 4 × H 2
अब प्रत्येक तत्व के परमाणुओं की संख्या दोनों ओर बराबर हो जाती है। इस प्रकार, यह समीकरण एक संतुलित समीकरण बन जाता है।
| परमाणु का नाम | अभिकारक में परमाणुओं की संख्या | उत्पाद में परमाणुओं की संख्या |
| लोहा | 3 | 3 |
| हाइड्रोजन | 8 | 8 |
| ऑक्सीजन | 4 | 4 |
संतुलित करने के बाद उपरोक्त समीकरण को इस प्रकार लिखा जा सकता है:
3Fe + 4H 2 O → Fe 3 O 4 + 4H 2 ।
समीकरणों को अधिक जानकारीपूर्ण बनाने
के लिए: रासायनिक समीकरण में पदार्थों की भौतिक अवस्थाओं के प्रतीकों को लिखना : पदार्थों
की भौतिक अवस्थाओं को लिखने से, एक रासायनिक समीकरण अधिक जानकारीपूर्ण हो जाता है।
- गैसीय अवस्था को प्रतीक (g) द्वारा दर्शाया जाता है।
- तरल अवस्था को प्रतीक (l) द्वारा दर्शाया जाता है।
- ठोस अवस्था को प्रतीक (ओं) द्वारा लिखा जाता है।
- जलीय विलयन को प्रतीक (aq) द्वारा लिखा जाता है।
- उस स्थिति को लिखना जिसमें प्रतिक्रिया होती है: स्थिति को आम तौर पर रासायनिक समीकरण के तीर के ऊपर और/या नीचे लिखा जाता है।
इस प्रकार, पदार्थों की भौतिक अवस्था तथा अभिक्रिया किस अवस्था में होती है, के प्रतीकों को लिखकर रासायनिक समीकरण को अधिक सूचनात्मक बनाया जा सकता है।
रासायनिक प्रतिक्रिया कक्षा 10 के प्रकार क्या हैं?
रासायनिक अभिक्रियाओं के प्रकार: संयोजन अभिक्रिया, अपघटन अभिक्रिया, विस्थापन अभिक्रिया, दोहरा विस्थापन अभिक्रिया, उदासीनीकरण अभिक्रिया, एक्ज़ोथिर्मिक - एंडोथर्मिक अभिक्रिया और ऑक्सीकरण-कमी अभिक्रिया।
रासायनिक अभिक्रियाओं के प्रकार:
रासायनिक अभिक्रियाओं को निम्नलिखित प्रकारों में वर्गीकृत किया जा सकता है:
(i) संयोजन अभिक्रिया: ऐसी अभिक्रियाएँ जिनमें दो या दो से अधिक अभिकारक मिलकर एक उत्पाद बनाते हैं, संयोजन अभिक्रियाएँ कहलाती हैं।
एक सामान्य संयोजन अभिक्रिया को यहाँ दिए गए रासायनिक समीकरण द्वारा दर्शाया जा सकता है:
A + B → AB
उदाहरण:
जब मैग्नीशियम को हवा (ऑक्सीजन) में जलाया जाता है, तो मैग्नीशियम ऑक्साइड बनता है। इस अभिक्रिया में मैग्नीशियम ऑक्सीजन के साथ संयोजित होता है।
Mg(s) + O2 (g) → 2MgO (s)
मैग्नीशियम + ऑक्सीजन → मैग्नीशियम ऑक्साइड
जब कार्बन को ऑक्सीजन (वायु) में जलाया जाता है, तो कार्बन डाइऑक्साइड बनता है। इस अभिक्रिया में कार्बन, ऑक्सीजन के साथ संयोजित होता है।
C (s) + O 2 (g) → CO 2 (g)
कार्बन + ऑक्सीजन → कार्बन डाइऑक्साइड
(ii) अपघटन अभिक्रिया: जिन अभिक्रियाओं में एक यौगिक दो या दो से अधिक यौगिकों या तत्वों में विघटित हो जाता है, उन्हें अपघटन अभिक्रिया के रूप में जाना जाता है। अपघटन अभिक्रिया संयोजन अभिक्रिया के ठीक विपरीत होती है।
एक सामान्य अपघटन अभिक्रिया को निम्न प्रकार दर्शाया जा सकता है:
AB → A + B
उदाहरण:
जब कैल्शियम कार्बोनेट को गर्म किया जाता है, तो यह कैल्शियम ऑक्साइड और कार्बन डाइऑक्साइड में विघटित हो जाता है।
सीएसीओ 3 (एस)
कैल्शियम कार्बोनेट → कैल्शियम ऑक्साइड + कार्बन डाइऑक्साइड
जब फेरिक हाइड्रॉक्साइड को गर्म किया जाता है, तो यह फेरिक ऑक्साइड और पानी
2Fe(OH) 3 (s) में विघटित हो जाता है।
ऊष्मीय अपघटन (Thermal Decomposition): किसी पदार्थ के गर्म होने पर अपघटन को ऊष्मीय अपघटन कहते हैं।
उदाहरण: 2Pb(NO 3 ) 2 (s)
विद्युतअपघटनी अपघटन (Electrolytic Decomposition): ऐसी अभिक्रियाएँ जिनमें विद्युत प्रवाहित होने के कारण यौगिक सरल यौगिकों में विघटित हो जाते हैं, इलेक्ट्रोलाइटिक अपघटन कहलाती हैं। इसे इलेक्ट्रोलिसिस के नाम से भी जाना जाता है।
उदाहरण: जब बिजली को पानी में प्रवाहित किया जाता है, तो यह हाइड्रोजन और ऑक्सीजन में विघटित हो जाता है।
2H 2 हे (एल)
फोटोलिसिस या फोटो अपघटन प्रतिक्रिया: ऐसी प्रतिक्रियाएं जिनमें सूर्य के प्रकाश के कारण एक यौगिक विघटित हो जाता है, फोटोलिसिस या फोटो अपघटन प्रतिक्रिया के रूप में जाना जाता है।
उदाहरण: जब सिल्वर क्लोराइड को सूर्य के प्रकाश में रखा जाता है, तो यह सिल्वर धातु और क्लोरीन गैस में अपघटित हो जाता है।
2AgCl(s) (सफेद)
फोटोग्राफिक पेपर में सिल्वर क्लोराइड की परत होती है, जो सूर्य के प्रकाश के संपर्क में आने पर ग्रे रंग में बदल जाती है। ऐसा इसलिए होता है क्योंकि सिल्वर क्लोराइड रंगहीन होता है जबकि सिल्वर ग्रे धातु है।
(iii) विस्थापन अभिक्रिया: वे रासायनिक अभिक्रियाएँ जिनमें अधिक क्रियाशील तत्व कम क्रियाशील तत्व को यौगिक से विस्थापित कर देता है, विस्थापन अभिक्रिया कहलाती है। विस्थापन अभिक्रियाओं को प्रतिस्थापन अभिक्रिया या एकल विस्थापन/प्रतिस्थापन अभिक्रिया के रूप में भी जाना जाता है।
एक सामान्य विस्थापन अभिक्रिया को रासायनिक समीकरण का उपयोग करके निम्न प्रकार से प्रदर्शित किया जा सकता है:
A + BC → AC + B
विस्थापन अभिक्रिया तभी होती है जब 'A', B से अधिक क्रियाशील हो। यदि 'B', 'A' से अधिक क्रियाशील हो, तो 'ए' 'बीसी' से 'सी' को विस्थापित नहीं करेगा और प्रतिक्रिया नहीं हो रही होगी।
उदाहरण:
जिंक जब हाइड्रोक्लोरिक अम्ल से अभिक्रिया करता है तो हाइड्रोजन गैस तथा जिंक क्लोराइड देता है।
Zn(s) + 2HCl(aq) → ZnCl2 ( aq) + H2 ( g)
जब जिंक कॉपर सल्फेट के साथ प्रतिक्रिया करता है तो यह जिंक सल्फेट और कॉपर धातु बनाता है।
Zn(s) + CuSO 4 (aq) → ZnSO 4 (aq) + Cu(s)
(iv) द्विविस्थापन अभिक्रिया: जिन अभिक्रियाओं में दो अभिकारकों के बीच आयनों का आदान-प्रदान होता है, वे नए यौगिक बनाते हैं, द्विविस्थापन अभिक्रिया कहलाती है।
AB + CD → AC + BD
उदाहरण:
जब बेरियम क्लोराइड का विलयन सोडियम सल्फेट के विलयन से अभिक्रिया करता है तो सोडियम क्लोराइड के साथ बेरियम सल्फेट का सफेद अवक्षेप बनता है।
BaCl 2 (aq) + Na 2 SO 4 (aq) → BaSO 4 (s) (अवक्षेपण) + 2NaCl (aq)
जब सोडियम हाइड्रोक्साइड (एक क्षार) हाइड्रोक्लोरिक एसिड के साथ अभिक्रिया करता है, तो सोडियम क्लोराइड और पानी बनता है।
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O ( l)
नोट: द्विविस्थापन अभिक्रिया, जिसमें अवक्षेप बनता है, अवक्षेपण अभिक्रिया भी कहलाती है। उदासीनीकरण अभिक्रियाएँ भी द्विविस्थापन अभिक्रिया के उदाहरण हैं।
अवक्षेपण अभिक्रिया: वह अभिक्रिया जिसमें दो लवणों के जलीय विलयन के मिलने से अवक्षेप बनता है, अवक्षेपण अभिक्रिया कहलाती है।
उदाहरण: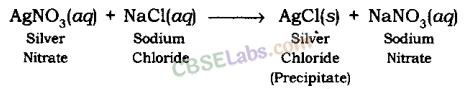
उदासीनीकरण अभिक्रिया: जिस अभिक्रिया में अम्ल, क्षार से अभिक्रिया करके आयनों के आदान-प्रदान द्वारा लवण और जल बनाता है, उदासीनीकरण अभिक्रिया कहलाती है।
उदाहरण: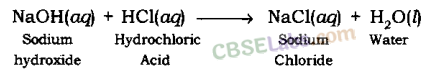
(v) उपचयन एवं अपचयन अभिक्रियाएँ :
उपचयन : किसी यौगिक में ऑक्सीजन अथवा अधात्विक तत्वों का योग अथवा हाइड्रोजन अथवा धातु के तत्वों का निष्कासन उपचयन कहलाता है।
जिन तत्वों या यौगिकों में ऑक्सीजन या अधातु तत्व मिलाए जाते हैं या हाइड्रोजन या धातु तत्व हटा दिए जाते हैं, उन्हें ऑक्सीकृत कहा जाता है।
अपचयन (Reduction) : किसी यौगिक से हाइड्रोजन या धातु तत्व का योग या ऑक्सीजन या अधात्विक तत्व का निष्कासन अपचयन कहलाता है।
जिस यौगिक या तत्व का अपचयन होता है, वह अपचयित कहलाता है।
ऑक्सीकरण तथा अपचयन एक साथ होते हैं।
ऑक्सीकरण एजेंट:
- ऑक्सीकरण के लिए ऑक्सीजन देने वाले पदार्थ को ऑक्सीकारक कहते हैं।
- हाइड्रोजन को हटाने वाले पदार्थ को ऑक्सीकारक भी कहा जाता है।
संदर्भ पुस्तकें:
- जो पदार्थ अपचयन के लिए हाइड्रोजन देता है उसे अपचायक कहते हैं।
- जो पदार्थ ऑक्सीजन को हटाता है उसे अपचायक भी कहते हैं।
जिस अभिक्रिया में ऑक्सीकरण तथा अपचयन दोनों एक साथ होते हैं, उसे रेडॉक्स अभिक्रिया कहते हैं।
जब कॉपर ऑक्साइड को हाइड्रोजन के साथ गर्म किया जाता है तो कॉपर धातु तथा हाइड्रोजन बनता है।
CuO + H2 → Cu + H2O ( i
) इस अभिक्रिया में CuO, Cu में परिवर्तित हो रहा है। कॉपर ऑक्साइड से ऑक्सीजन निकाली जा रही है। किसी पदार्थ से ऑक्सीजन का निष्कासन अपचयन कहलाता है, अतः कॉपर ऑक्साइड का कॉपर में अपचयन हो रहा है।
(ii) इस अभिक्रिया में H2, H2O में बदल रहा है। हाइड्रोजन में ऑक्सीजन मिलाई जा रही है । किसी पदार्थ में ऑक्सीजन का जुड़ना ऑक्सीकरण कहलाता है, इसलिए हाइड्रोजन का पानी में ऑक्सीकरण हो रहा है।
- जो पदार्थ ऑक्सीकृत हो जाता है वह अपचायक है।
- जो पदार्थ अपचित हो जाता है वह ऑक्सीकारक है।
(vi) एक्ज़ोथिर्मिक और एंडोथर्मिक रिएक्शन:
एक्ज़ोथिर्मिक रिएक्शन: वह रिएक्शन जो ऊर्जा पैदा करती है, एक्ज़ोथिर्मिक रिएक्शन कहलाती है। अधिकांश अपघटन अभिक्रियाएँ ऊष्माक्षेपी होती हैं।
उदाहरण:
श्वसन एक अपघटन प्रतिक्रिया है जिसमें ऊर्जा मुक्त होती है।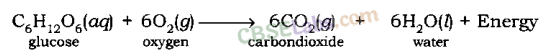
जब बिना बुझा चूना (CaO) पानी में डाला जाता है, तो यह ऊर्जा मुक्त करता है।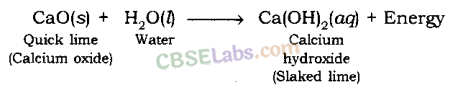
एंडोथर्मिक रिएक्शन: एक रासायनिक प्रतिक्रिया जिसमें ऊष्मा ऊर्जा अवशोषित होती है, एंडोथर्मिक रिएक्शन कहलाती है।
उदाहरण: कैल्शियम कार्बोनेट का अपघटन।
रोजमर्रा की जिंदगी में ऑक्सीकरण प्रतिक्रियाओं के प्रभाव: जंग और बासीपन।
संक्षारण (Corrosion) : वायुमण्डल में उपस्थित ऑक्सीजन, जल, अम्ल, गैसों आदि की अभिक्रिया के कारण धातुओं का उनके अवांछनीय यौगिकों में धीमी गति से परिवर्तन की प्रक्रिया संक्षारण कहलाती है।
उदाहरण : लोहे में जंग लगना।
जंग लगना: लोहा जब ऑक्सीजन के साथ प्रतिक्रिया करता है और नमी से लाल पदार्थ बनता है जिसे जंग कहा जाता है।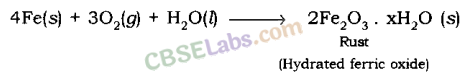
लोहे में जंग लगना एक रेडॉक्स अभिक्रिया है।
जंग (जंग लगना) लोहे और स्टील की वस्तुओं और संरचनाओं जैसे रेलिंग, कार बॉडी, पुल और जहाज आदि को कमजोर कर देता है और उनके जीवन को कम कर देता है।
जंग लगने से बचाने के उपाय
- पेंटिंग करके।
- ग्रीसिंग और तेल लगाने से।
- गैल्वेनाइजेशन द्वारा।
तांबे का क्षरण: तांबे की वस्तुएं कुछ समय बाद अपनी चमक और चमक खो देती हैं क्योंकि हवा के संपर्क में आने पर इन वस्तुओं की सतह पर बेसिक कॉपर कार्बोनेट, CuCO3 .Cu (OH) 2 की हरी परत चढ़ जाती है।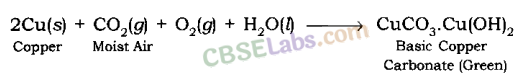
चांदी धातु का क्षरण: हवा के संपर्क में आने पर चांदी की धातु की सतह धूमिल हो जाती है, इसकी सतह पर ब्लैक सिल्वर सल्फाइड (Ag 2 S) की परत बनने के कारण इसमें मौजूद H 2 S गैस की क्रिया होती है। हवा।
विकृतगंधिता: वसा और तेल युक्त खाद्य पदार्थों का स्वाद और गंध तब बदल जाता है जब उन्हें लंबे समय तक हवा के संपर्क में रखा जाता है। इसे बासीपन कहते हैं। यह खाद्य पदार्थों में मौजूद वसा और तेल के ऑक्सीकरण के कारण होता है।
बासीपन रोकने के उपाय:
- एंटी-ऑक्सीडेंट मिलाकर।
- वैक्यूम पैकिंग।
- नाइट्रोजन द्वारा हवा की जगह।
- खाद्य पदार्थों का प्रशीतन।
1. रासायनिक अभिक्रिया: रासायनिक अभिक्रिया के दौरान पदार्थों के रासायनिक संघटन में परिवर्तन होता है या नए पदार्थ बनते हैं।
2. रासायनिक समीकरण: रासायनिक अभिक्रियाओं को रासायनिक समीकरण के रूप में लिखा जा सकता है जो सदैव संतुलित होनी चाहिए।
3. रासायनिक अभिक्रियाओं के प्रकार:
संयोजन अभिक्रिया: दो या दो से अधिक अभिकारकों से एक एकल उत्पाद बनता है।
2 एमजी + ओ 2 → 2एमजीओ
अपघटन अभिक्रिया: एक एकल अभिकारक दो या दो से अधिक उत्पाद बनाने के लिए टूट जाता है।
- थर्मल अपघटन: 2Pb(NO 2 ) 2 → 2PbO + 4NO 2 + O 2
- इलेक्ट्रोलिसिस: 2H20 → 2H 2 + O 2
- फोटोकैमिकल रिएक्शन: 2AgBr → 2Ag + Br 2
विस्थापन अभिक्रिया: एक तत्व को दूसरे तत्व द्वारा विस्थापित किया जाता है।
Zn + CuSO 4 → ZnSO 4 + Cu
द्विविस्थापन अभिक्रिया: अभिकारकों के बीच आयनों का आदान-प्रदान।
AgNO 3 + NaCl → AgCl + NaNO 3
रेडॉक्स अभिक्रिया: ऑक्सीकरण तथा अपचयन दोनों साथ-साथ होते हैं।
क्यूओ + एच 2 → क्यू + एच 2 ओ
एक्ज़ोथिर्मिक प्रतिक्रिया: एक रासायनिक प्रतिक्रिया जिसमें ऊष्मा ऊर्जा विकसित होती है।
सी + ओ 2 → सीओ 2 (जी) + गर्मी
एंडोथर्मिक प्रतिक्रिया: एक रासायनिक प्रतिक्रिया जिसमें ऊष्मा ऊर्जा अवशोषित होती है।
ZnCO 3 + ऊष्मा → ZnO + CO 2
रेडॉक्स अभिक्रिया: रासायनिक अभिक्रिया जिसमें ऑक्सीकरण और अपचयन दोनों एक साथ होते हैं।
4. ऑक्सीकरण: प्रतिक्रिया जिसमें ऑक्सीजन का लाभ या हाइड्रोजन का नुकसान होता है।
5. अपचयन : वह अभिक्रिया जो ऑक्सीजन की हानि या हाइड्रोजन की प्राप्ति दर्शाती है।
ZnO + C → Zn + CO
ZnO को Zn-कमी में घटाया जाता है। C का CO-ऑक्सीकरण में ऑक्सीकरण होता है।
6. हमारे दैनिक जीवन में ऑक्सीकरण प्रतिक्रियाओं के प्रभाव:
- संक्षारण: यह एक अवांछनीय परिवर्तन है जो धातुओं में नमी, वायु, अम्ल और क्षार द्वारा हमला किए जाने पर होता है।
उदाहरण, लोहे का संक्षारण (जंग लगना ) : Fe2O3 । एनएच 2 ओ (हाइड्रेटेड आयरन ऑक्साइड) - विकृतगंधिता: फैटी एसिड के ऑक्सीकरण के कारण तेल युक्त खाद्य पदार्थों में होने वाला अवांछित परिवर्तन।
बासीपन की रोकथाम के तरीके: खाद्य पदार्थों में एंटी-ऑक्सीडेंट मिलाना, एयरटाइट कंटेनर में भोजन का भंडारण करना, नाइट्रोजन गैस और प्रशीतन के साथ हवा को बाहर निकालना।





0 Comments